年终盘点 | 2021年度药政法规十大关键词
凡是过往,皆为序章
2021年,药品管理法配套措施逐步落地
对于医药人而言
有很多值得被铭记的时刻
也有很多被值得记忆的“关键词”。

药物警戒是与发现、评价、理解和预防不良反应或其他任何可能与药物有关问题的科学研究与活动,在发现和预防药品安全风险等方面的作用至关重要。
- 2021年11月8日,国家药品不良反应监测中心发布《药物警戒体系主文件撰写指南》(征求意见稿)
- 2021年12月1日,国家局综合司发布《药物警戒检查指导原则》(征求意见稿)。《药物警戒质量管理规范》正式实施,意味着药物警戒制度在中国迈出了坚实的一步。
药物警戒系列文件的相继出台为药物警戒制度的加快落地奠定了坚实的基础。期待建立更加健全完善的药物警戒制度体系,为公众健康保驾护航。

NMPA于2017加入ICH,并在CDE设立ICH办公室。ICH指导原则共 63个,明确实施时间点59个,已转化实施53个。ICH指导原则的转化实施为e-CTD的实施奠定了基础。
- 2021年9月29日,NMPA发布《国家药监局关于实施药品电子通用技术文档申报的公告》(2021年第119号),明确自2021年12月29日起,化学药品注册分类1类、5.1类,以及治疗用生物制品1类和预防用生物制品1类的上市许可申请,可按照eCTD进行申报。这表明中国正式进入eCTD申报时代。
- 2021年11月18日,CDE联合中国药品监督管理研究会举办了eCTD 申报培训,并在线上培训后一个月公布了培训资料,供企业查看学习。
- 2021年12月10日,CDE官网公布了eCTD 验证软件和PDF文件批量电子签章软件,可免费下载使用。
这一系列举措均表明eCTD的全面实施势在必行,申请人可根据实际情况采购eCTD申报软件或与第三方合作,以便尽快适应eCTD申报模式。
- 2021年7月,国家药品监督管理局联合国家知识产权局发布《药品专 利纠纷早期解决机制实施办法(试行)》及《药品专利纠纷早期解决机制实施办法(试行)》政策解读。
《药品专利纠纷早期解决机制实施办法(试行)》也被称为是中国特色的药品专利链接制度,在中国首次将药品审评审批与药品专利相链接,在药品监管实践层面具有一定的创新性。
药品专利链接制度一方面充分考虑药物专利,鼓励药物创新,另一方面设立专利挑战,给予专利挑战成功的首仿药12个月的市场独占期,一定程度上可平衡创新药和仿制药的发展。
2021年,NMPA 及CDE陆续发布变更指导原则,涉及化药、中药及生物药药学/临床变更研究、变更程序、变更受理审查指南。明确了变更研究内容,疏通了变更申报路径。
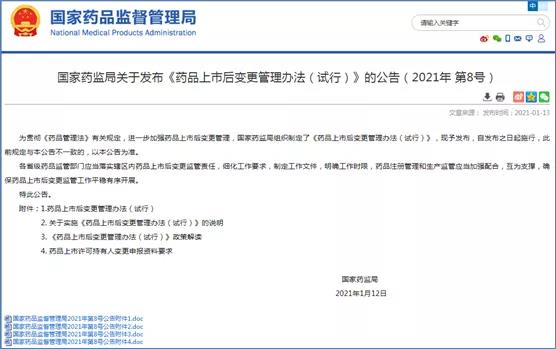
2021年开年发布的《药品上市后变更管理办法》(试行)明确了MAH路径及变更资料要求,同时明确了MAH变更同时伴随生产场地变更、工艺变更及质量标准变更的注册申报路径。对于变更风险等级的划分,可通过与省局/CDE沟通确认,优化了监管服务,进一步体现了“放管服”的要求。
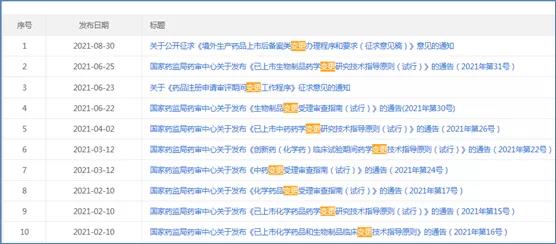
参比制剂目录作为仿制药立项的风向标,注册申报受理的头号关卡,备受瞩目。
2021年共发布了《化学仿制药参比制剂目录》19批,截止2021年12月31日已发布五十三批(第50-53批为征求意见稿)。同时也公布了一些未通过审议参比制剂的原因,包括安全性和有效性、不具有参比制剂地位以及无菌生产工艺/灭菌工艺选择问题等。
随着一致性评价制度的推进,CDE亦发布《临床价值明确,无法推荐参比制剂的化学药品目录》,但未发布正式稿。医药企业翘首以盼,期待尽快落地!
- 2017年国务院发布发布的42号文,明确提出“支持罕见病治疗药品医疗器械研发。罕见病治疗药品医疗器械注册申请人可提出减免临床试验的申请。”
- 2021年9月11日,《中国罕见病定义研究报告2021》在上海发布,报告中首次提出了“中国罕见病2021年版定义”,即应将“新生儿发病率小于1/万、患病率小于1/万、患病人数小于14万的疾病”列入罕见病。
2021年,CDE发布两则关于罕见病用药的临床研发指导原则,通过优先审评审批方式批准2款罕见病用药,分别为奥法妥木单抗注射液(用于治疗成人复发型多发性硬化(RMS)) 和注射用司妥昔单抗(用于人体免疫缺陷病毒(HIV)阴性和人疱疹病毒8型(HHV-8)阴性的多中心Castleman病(MCD)成人患者)。
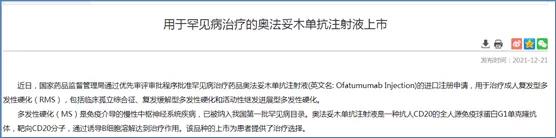
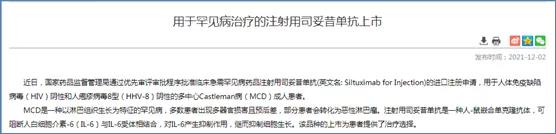
在仿制药市场红利逐渐减弱的情况下,企业不妨抓住政策机遇,另辟蹊径,采用license in或与深耕罕见病研发的国内外研究机构合作,布局罕见病领域,提前抢占罕见病用药市场。
国家从多维度推动儿童用药的可及性,如政策法规层面鼓励研发创新, 审评审批方面将儿童用药新药纳入优先审评审批范畴,开通“儿童用药专栏”,并将与儿童用药相关的政策法规、指导原则及培训资料等予以集中公开,打出了鼓励创新、提升效率,强化服务的“组合拳”。
截止目前,CDE共发布10余个关于儿童用药的指导原则,涉及临床研究及药学研究,并明确了成人用药数据外推至儿科人群的技术要求,其中2021年CDE共发布2项关于儿童用药指导原则。随着国家监管政策的倾斜,儿童用药也逐步成为制药企业重要的战略布局点。

- 2017年10月8日,国务院发布《关于深化审评审批制度改革鼓励药品 医疗器械创新的意见》(厅字〔2017〕42号)。作为纲领性文件,42号文指明了药品审评审批制度改革的方向。
- 2021年,CDE共发布4个关于创新药的指导原则,持续释放政策利好信息;NMPA通过优先审评审批通道共批准包括帕米帕利胶囊在内19款创新药,均为具有我国自主知识产权的新药,有效促进了未满足的临床需求!
2015年1月,前美国总统奥巴马在国情咨文中提出“精准医学”行动策略,随之众多企业将细胞治疗和基因治疗疗法纳入其战略布局。同时,随着CAR-T疗法的火热,细胞治疗进入了大众视野。
- 2021年,CDE发布10项细胞/基因治疗产品研究指导原则,涉及非临床研究、药学研究、临床研究;NMPA批准国内首款CAR-T细胞疗法-阿基伦赛注射液(用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者)上市,这也是我国首个批准上市的细胞治疗类产品。

2021年,CDE共发布临床/非临床试验指导原则数量:34个,包括创新药、抗肿瘤药、基因治疗产品、抗新冠病毒药物、儿童用药以及个药指南等。
从发布的指导原则中可得出两个鲜明的“特征”:
-
“私人订制”,发布多个个药指南以及某治疗领域产品临床研究指导原则,这对于申办方规范临床研究明确研究方向具有重要意义;
-
从“跟随”到“领跑”,如首创新的发布抗新冠病毒化学药品非临床研究指导原则。中国监管当局在不断优化监管环境,强化服务。
2022年,药政法规将进一步完善和全面,
希望医药企业能够按照法规要求及时调整修改,
为医药的研发保驾护航,
助力医药大健康!
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450