策略分析 | 罕见病用药领域市场现状、法规剖析及开发策略
罕见疾病是人类医学面临的最大挑战之一,目前已知的罕见病有近7000种,约占人类疾病的10%。在种类繁多的罕见病当中,约有80%是由于基因缺陷所导致的,具有遗传性。因罕见病患病人数少,治疗罕见疾病的药物也被称为“孤儿药(orphan drug)”。
由于各国的罕见病政策壁垒,这些药物只在为数不多的国家和地区上市,包括中国在内的更多国家的患者,面临无药可医的窘境,罕见病日渐成为一个全球公共健康优先事务。
2016年,据复旦大学出生缺陷研究中心数据显示,我国约有1680万罕见病患者。目前,中国尚无罕见病官方定义,专家共识为患病率低于1/50万,或新生儿发病率低于0.1‰的疾病。
✎ 定义:
✎ 罕见病用药短缺严重,主要依赖进口:
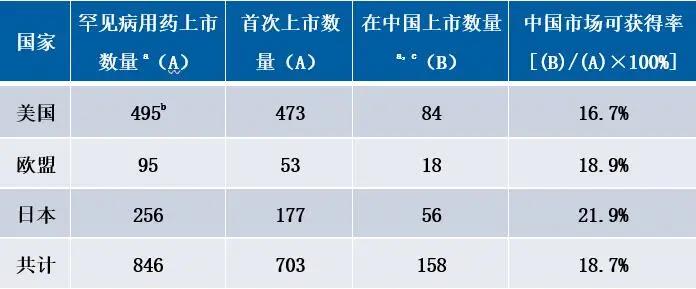
来源:FDA官网整理
备注:a指罕见病用药的种类;b包含撤回的罕见病用药;c截止2018年9月30日。
✎ 较多罕见病治疗领域用药可获得性较低:
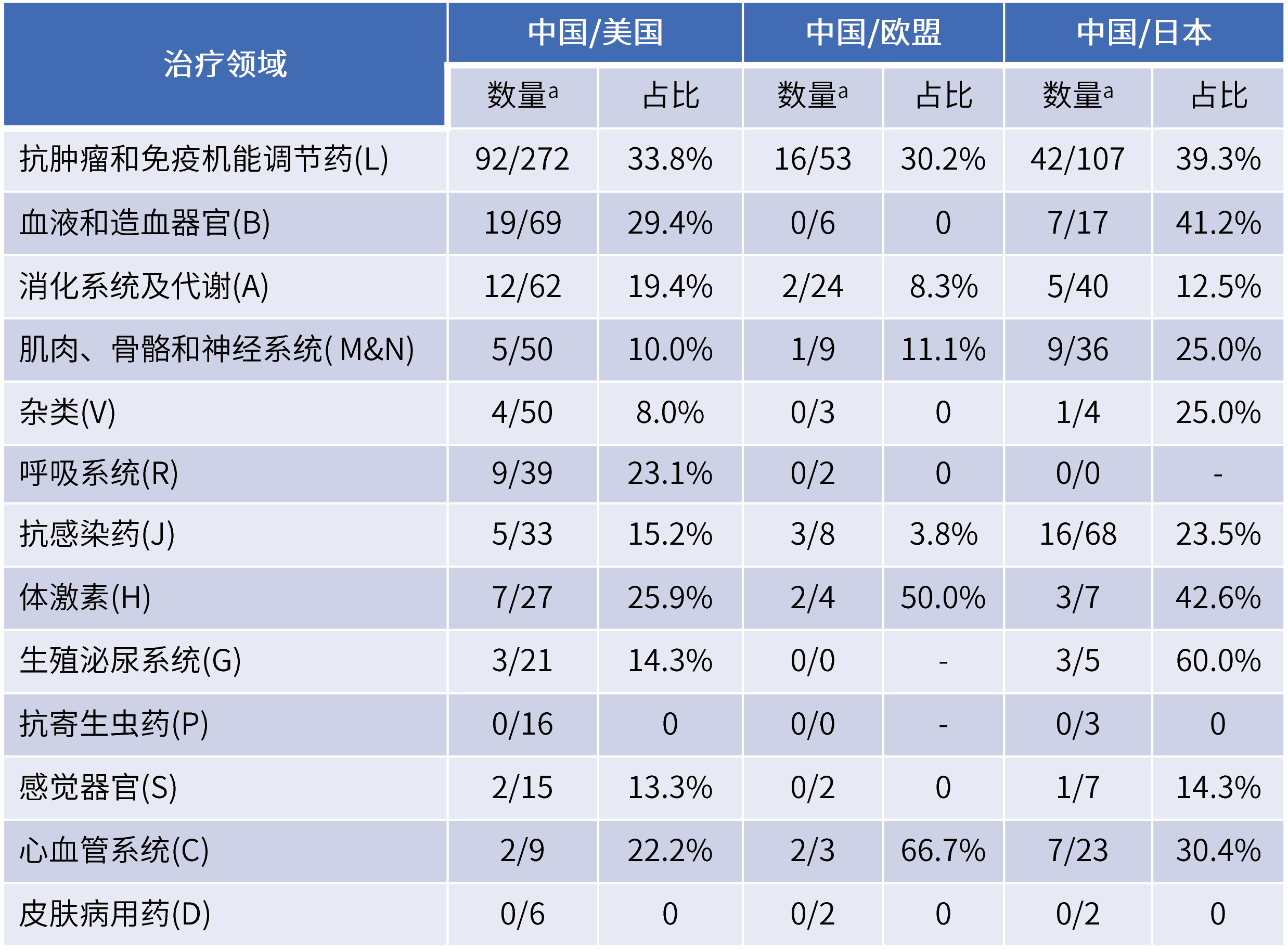
来源:FDA官网整理
其中,在众多治疗领域中,消化系统及代谢治疗领域、抗寄生虫治疗领域和皮肤病治疗领域可获得性占比为零,罕见病市场具有较大的缺口。
✎ 2017年前法规——实现鼓励到支持的转变、特殊审评通道:
2007
-
《药品注册管理办法》:特殊审评。
2009
-
新药注册审批管理规定:单独设立审评审批通道、 多途径动态补充资料、 多渠道沟通交流。
2013
-
关于深化药品审批改革进一步鼓励药物创新:对重大疾病、罕见病、老年人和儿童疾病具有更好治疗作用、具有自主知识产权的创新药物注册申请等,给予加快审评。确立仿制药优先审评领域。罕见病可实行优先审评。
2015
-
《关于药品注册审评审批若干政策的公告》:加快临床继续等药品的审批;对防治艾滋病、恶性肿瘤、重大传染病和罕见病等疾病的创新药注册审评。
2017
-
《关于鼓励药品创新实行有限审评审批的意见》:防治罕见病且具有临床优势的药品。
-
《关于深化审评审批制度改革管理鼓励药品医疗器械创新的意见》:支持罕见病用药研发;可提出减免临床试验的申请。
✎ 新版《药品管理法》——优先配置审评资源,缩短审评时限:
2019
-
《药品管理法》:
第十六条:国家支持以临床价值为导向、对人的疾病具有明确或者特殊疗效的药物创新,鼓励具有新的治疗机理、治疗严重危及生命的疾病或者罕见病、对人体具有多靶向系统性调节干预功能等的新药研制,推动药品技术进步。
第六十六条:国家鼓励短缺药品的研制和生产,对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评审批。
2020
-
《药品注册管理办法》:
第六十八条:药品上市许可申请时,以下具有明显临床价值的药品,可以申请适用优先审评审批程序:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药。
第九十六条:药品上市许可申请审评时限为二百日,其中优先审评审批程序的审评时限为一百三十日。
✎ 新版《药品管理法》——特殊审评审批:
2020
-
突破性治疗药物工作程序:
适用范围:用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药。
适用时期:药物临床试验期间。
政策优惠:研发期间沟通交流 临床试验研制指导。优先配置资源沟通交流, 加强指导,促进药物研发。
-
优先审评审批工作程序
适用范围:药品具有明显临床价值,临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药。
审评时限:药品上市许可申请审评时限为二百日,其中优先审评审批程序的审评时限为一百三十日。
审批时限:行政审批决定应当在10日内作出。
补充提交技术资料:在审评期间提交技术资料,不延长审评时限。
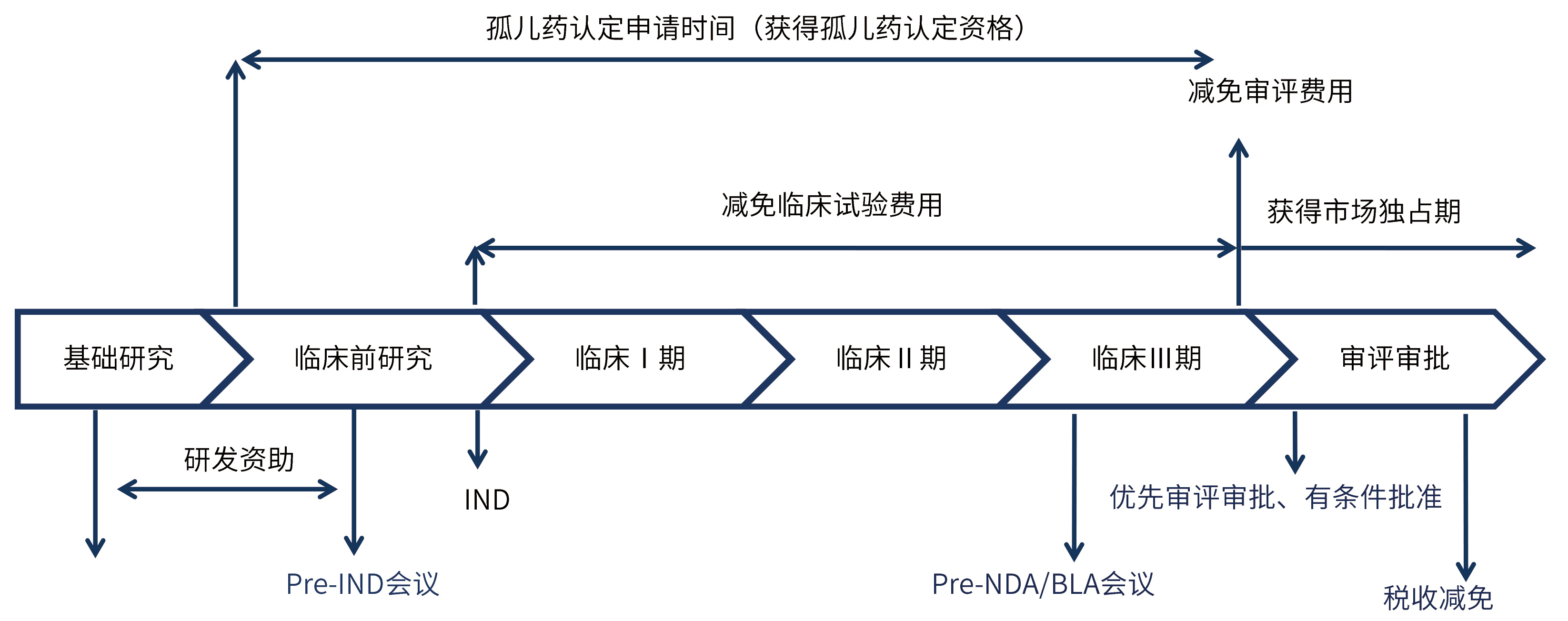
✎ 罕见病用药开发激励措施:
随着相关政策法规的进一步完善, 越来越多治疗罕见病的药物进行申报审批。
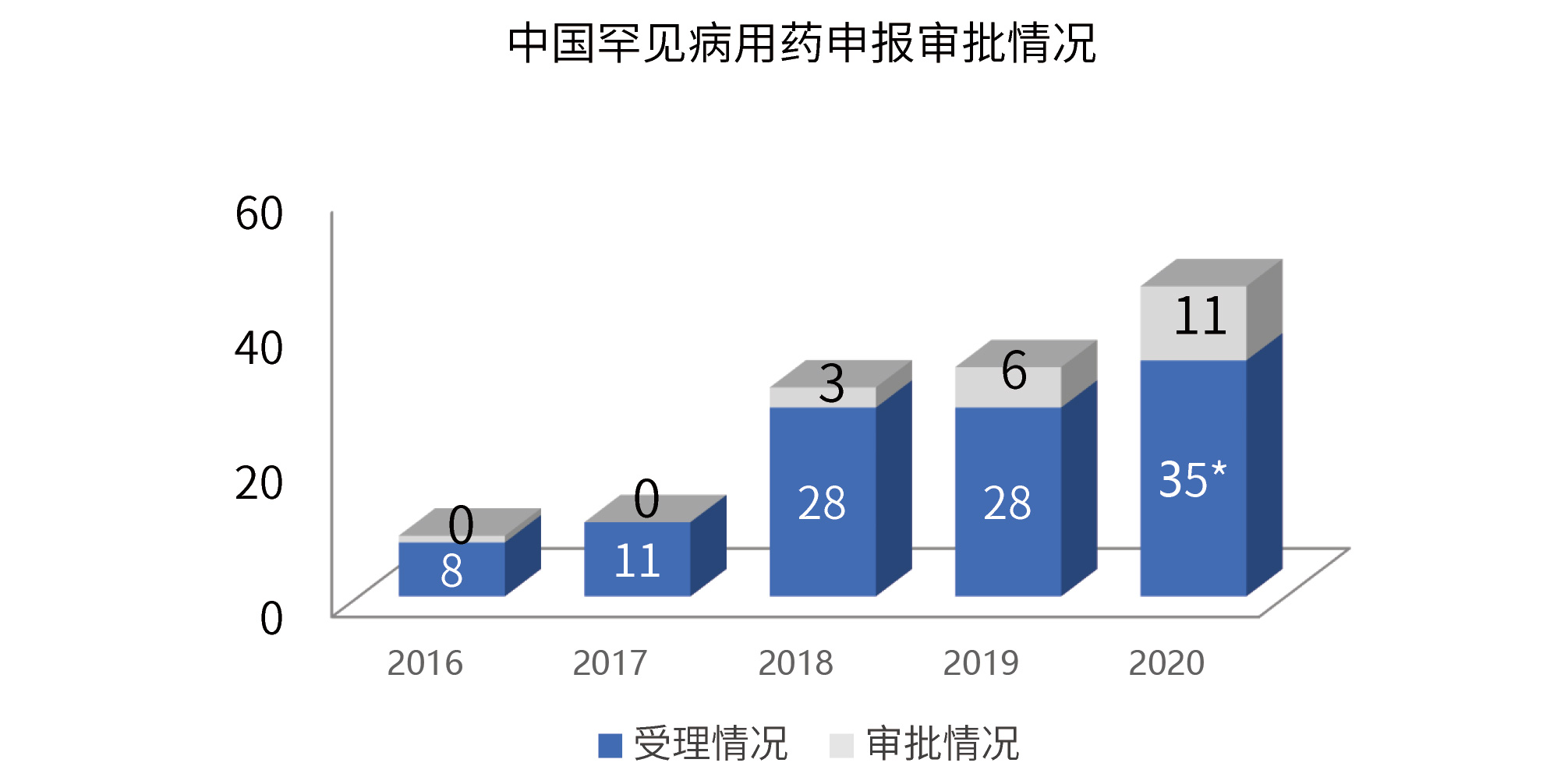
*2020年版《药品注册管理办法》后,临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药合并计算
✎ 适应症重新定位:
-
开发常见疾病治疗药物在罕见病治疗领域的新适应症。
-
开发罕见病用药物针对其他罕见病的新适应症。
-
开发罕见病用药物针对常见疾病的新适应症。
eg:2017年,FDA批准上市的罕见病用药中,约9.83%的罕见病用药有2种及2种以上的罕见病适应症。
✎ 罕见疾病药物临床试验开发计划示例:
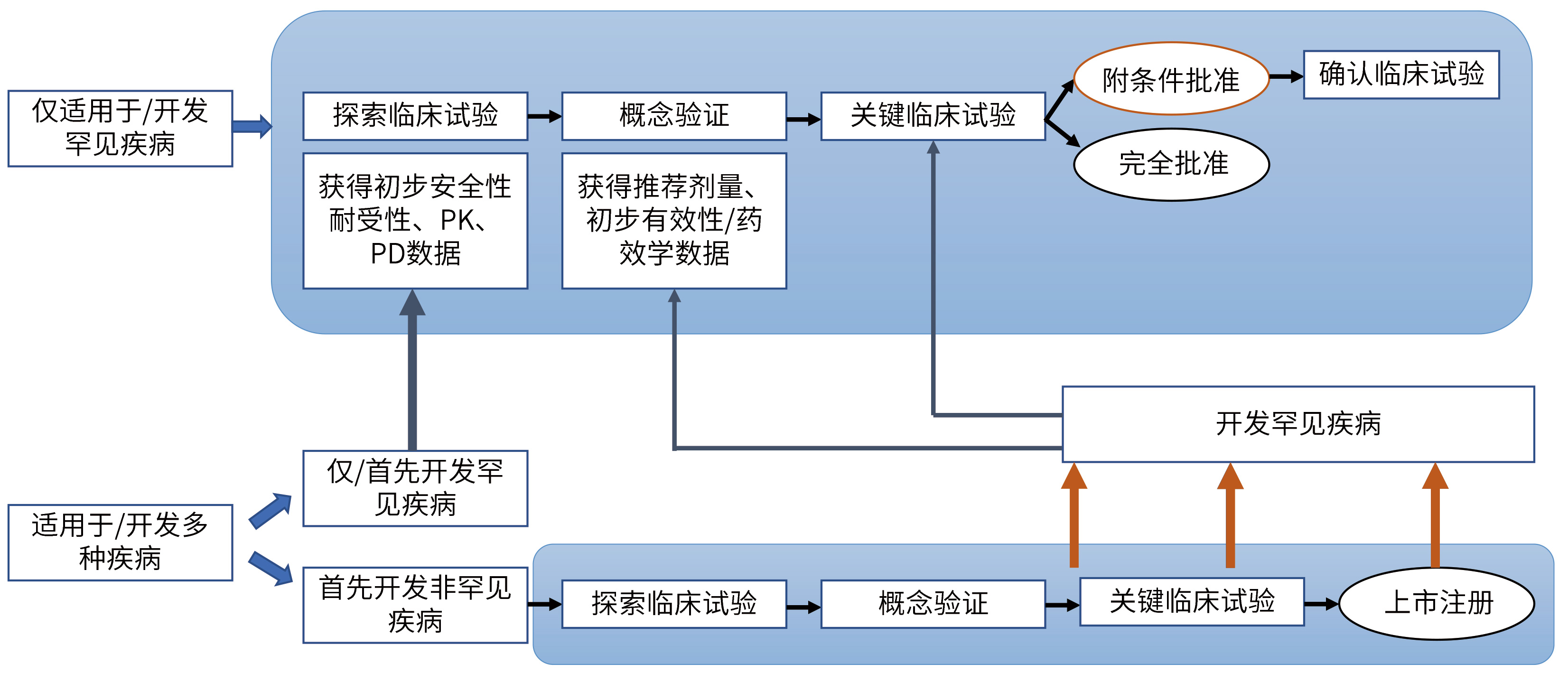
在仿制药市场红利逐渐较弱的情况下,企业不妨抓住政策机遇,可另辟蹊径,采用license in或与深耕罕见病研发的国内外研究机构合作,布局罕见病领域,提前抢占罕见病用药市场。
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450