收藏!中药品种保护和注册申报流程详解
为提高中药品种质量,保护中药生产企业合法利益,对质量稳定、疗效确切的中药品种实行分级保护。受保护的中药品种,必须是列入国家药品标准的品种。经国务院卫生行政部门认定,列为省、自治区、直辖市药品标准的品种,也可以申请保护。
中药保护品种申请办理基本流程

中药品种的保护期限
根据《中药品种保护条例》,国家对受保护的中药品种划分一级和二级。中药一级保护品种分别为三十年、二十年、十年;中药二级保护品种为七年。

-
中药一级保护品种因特殊情况需要延长保护期限的,延长的保护期限由国务院卫生行政部门根据国家中药品种保护审评委员会的审评结果确定;但是,每次延长的保护期限不得超过第一次批准的保护期限。
-
中药二级保护品种在保护期满后可以延长七年。
02 中药注册发展及要求
政策沿革
1963年 《关于药政管理的若干规定》
首次明确了药品的定义、审批程序、临床研究、生产审批及审批的药品范围。
1985年 《新药审批办法》
首次将新药分成中药、西药和生物制品三大类别,明确了新药的定义(我国未生产的药品)。
1999年 《新药审批办法》
将新的中药复方制剂亦按新药管理。该办法将中药分为五个大类,增加了中药注射剂、有效成分、复方有效部位群等小类,将新增主治病证的药品列为第五大类。
2007年 《药品注册管理办法》(2007版)
将中药细化为9个注册类别,1-6类为新药,7类、8类为改变给药途径和改剂型品种,9类为仿制药。
明确了中药复方制剂注册申报的相关要求。
2020年 《药品注册管理办法》(2020年版)
分为创新药、改良型新药、古代经典名方复方制剂、同名同方等。
中药注册主要分为中药创新药、中药改良型新药、古代经典名方重要复方制剂、同名同方药及其他在境外已上市境内未上市的中药、天然药物制剂。
中药创新药指处方未在国家药品标准、药品注册标准及国家中医药主管部门发布的《古代经典名方目录》中收载,具有临床价值,且未在境外上市的中药新处方制剂。主要涵盖中药复方制剂、新药材及其制剂、从单一植物、动物、矿物等物质中提取得到的提取物及其制剂。
-
中药复方制剂系指由多味饮片、提取物等在中医药理论指导下组方而成的制剂。
-
新药材及其制剂系指即未被国家药品标准、药品注册标准以及省、自治区、直辖市药材标准收载的药材及其制剂,以及具有上述标准药材的原动、植物新的药用部位及其制剂。
中药改良型新药指改变已上市中药的给药途径、剂型,且具有临床应用优势和特点,或增加功能主治等的制剂。一般包含以下情形:
-
改变已上市中药给药途径的制剂,即不同给药途径或不同吸收部位之间相互改变的制剂。
-
改变已上市中药剂型的制剂,即在给药途径不变的情况下改变剂型的制剂。
-
中药增加功能主治。
-
已上市中药生产工艺或辅料等改变引起药用物质基础或药物吸收、利用明显改变的。
古代经典名方中药复方制剂是指来源于古代经典名方的中药复方制剂,涵盖:
-
按古代经典名方目录管理的中药复方制剂。
-
其他来源于古代经典名方的中药复方制剂。包括未按古代经典名方目录管理的古代经典名方中药复方制剂和基于古代经典名方加减化裁的中药复方制剂。
同名同方药指通用名称、处方、剂型、功能主治、用法及日用饮片量与已上市中药相同,且在安全性、有效性、质量可控性方面不低于该已上市中药的制剂。
中药临床注册申报流程
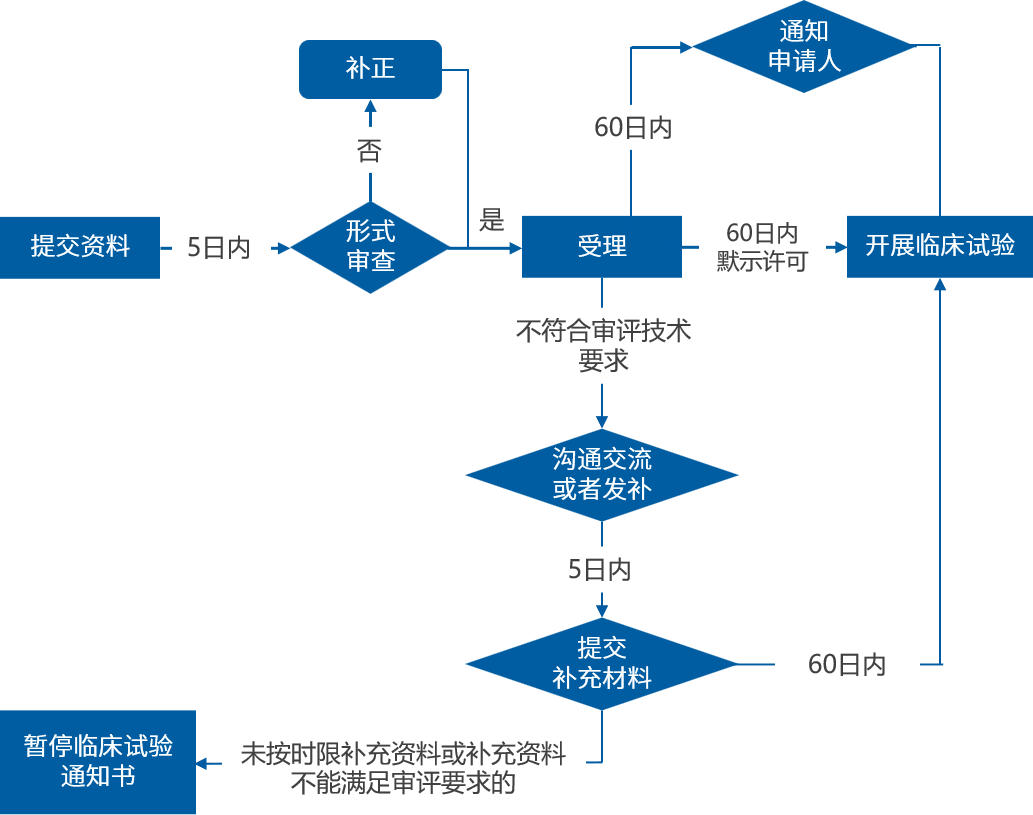
中药报产注册申报流程
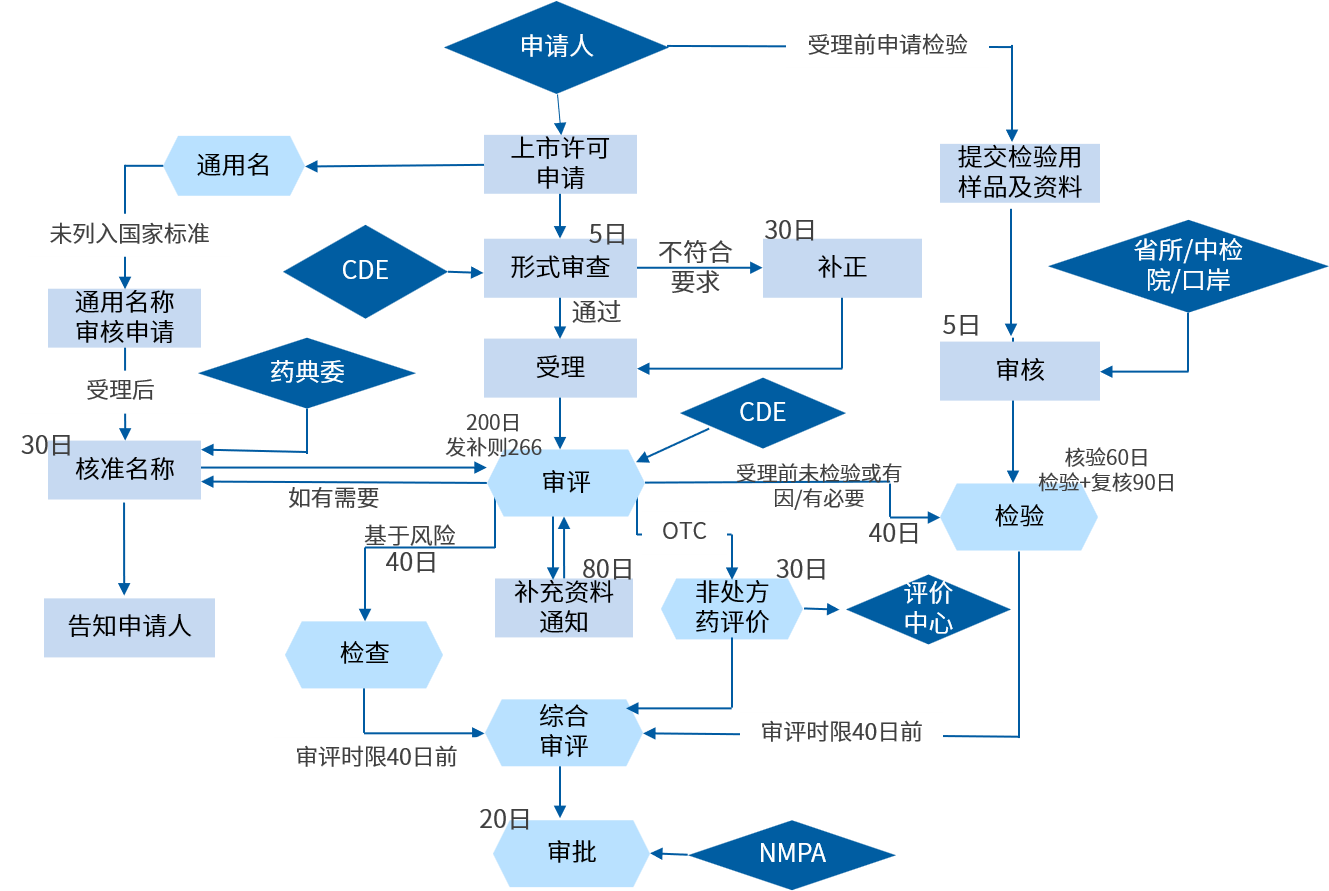
古代经典名方中药复方制剂简化注册审批

-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450