政策法规||本周重磅政策法规概览(20.11.23-11.27)
NMPA/CDE/CFDI/药典委公布药品/医疗器械相关内容本周集锦。
NMPA
01
本周共计77+53个品种获批取得药品批准证明文件(特殊药品批文53个),其中一致性评价品种12个。
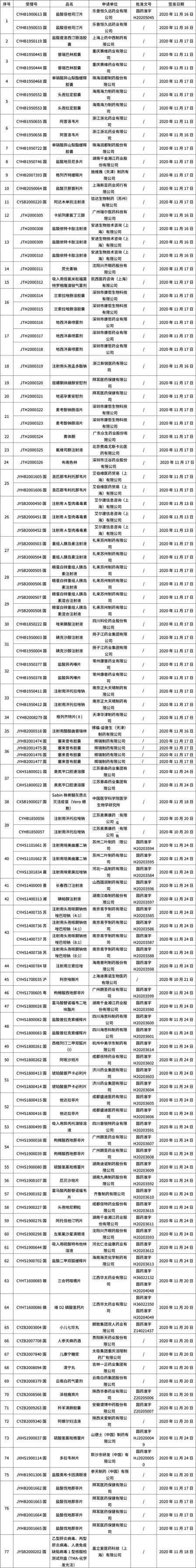
02
关于发布仿制药参比制剂目录(第三十一批)、(第三十二批)的通告
两批次共计202个品规参比制剂来源公布,其中头孢呋辛酯片、利丙双卡因乳膏等因持证商名称或通用名称变更公示。

扫描下方二维码
查看详细信息


扫描下方二维码
查看详细信息

03
关于发布真实世界数据用于医疗器械临床评价技术指导原则(试行)的通告(2020年第77号)
为规范和指导真实世界数据在医疗器械临床评价中的应用,该指导原则予以发布并执行。

扫描下方二维码
查看详细信息

04
关于带垫片的不可吸收缝合线等产品分类及注册有关事项的通知 药监综械注函〔2020〕721号
配合不可吸收缝合线使用的垫片(以下简称垫片)、带垫片的不可吸收缝合线均按照第三类医疗器械管理,分类编码02-13。
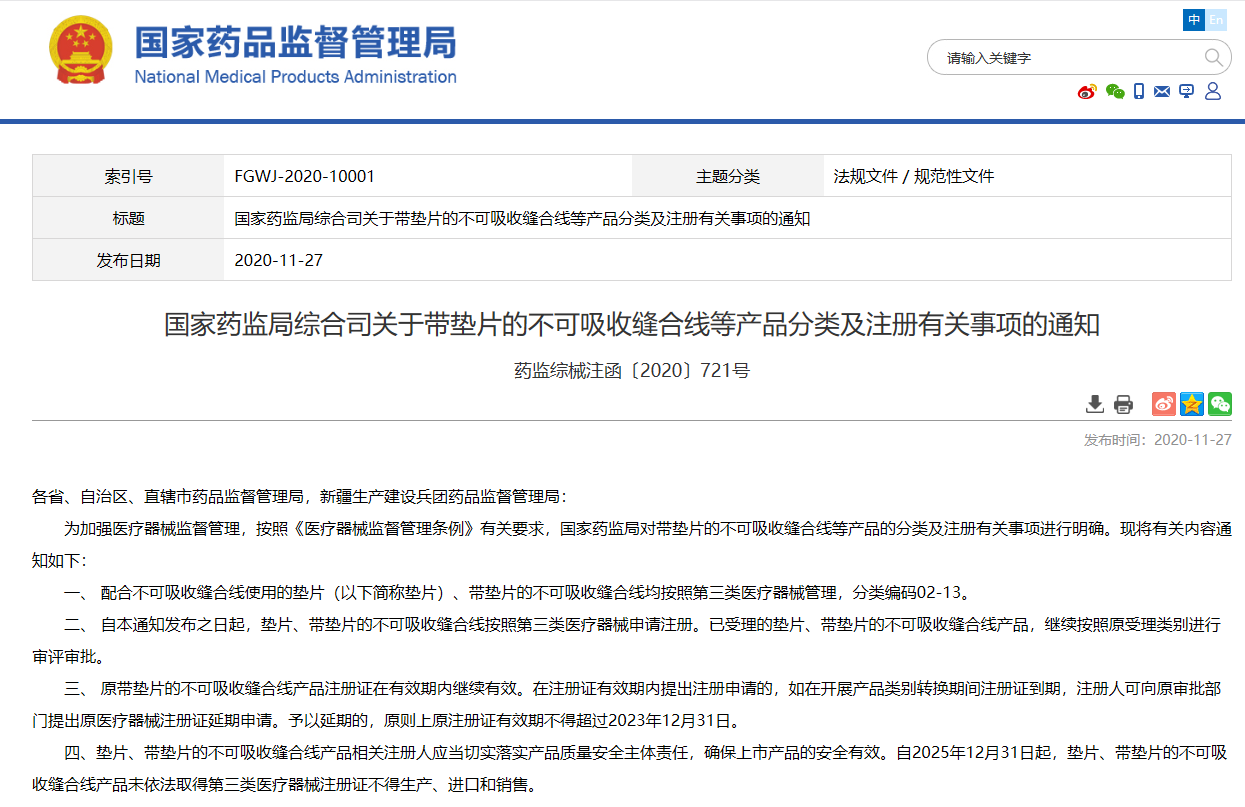
扫描下方二维码
查看详细信息

CDE
01
关于发布《化学药品创新药I期临床试验申请药学共性问题相关技术要求》和《化学药品I期临床试验申请药学研究信息汇总表(修订版)》的通告(2020年第40号)
药审中心组织制定了《化学药品创新药I期临床试验申请药学共性问题相关技术要求》,同时对原食品药品监管总局《关于发布〈新药I期临床试验申请技术指南〉的通告》(2018年第16号)中所附《化学药品I期临床试验申请药学研究信息汇总表》进行了修订,并于11月12日起执行。

扫描下方二维码
查看详细信息

02
关于公开征求《疫苗临床试验抗体分析方法研究技术指导原则》意见的通知
为进一步规范和指导疫苗临床试验抗体分析的研究,该指导原则予以意见征求,时间截至至12月23日。

扫描下方二维码
查看详细信息

03
关于发布《药品审评中心补充资料工作程序(试行)》的通告(2020年第42号)
为进一步规范药品注册审评补充资料管理工作,结合药品审评以流程为导向的科学管理体系的研究成果和审评工作实际,该通告自12月1日起正式执行,各申请人注意发补通知件中期限要求。

扫描下方二维码
查看详细信息

药典委
本周奥沙拉秦钠胶囊、阿胶益寿口服液、富马酸替诺福韦二吡呋酯、卡培他滨片标准公示,及金银花配方颗粒、熟地黄配方颗粒、淡竹叶配方颗粒、酒女贞子配方颗粒、淫羊藿配方颗粒、黄芪配方颗粒、炙淫羊藿配方颗粒、生地黄配方颗粒试点统一标准公示(第二次)。

扫描下方二维码
查看详细信息

-END-
关于我们:
药政部是隶属于公司副总裁直接领导下的部门,以国家药品政策为导向,以为客户提供集药物研发、注册申报、现场核查等一体化专业技术服务为宗旨,以高效、成功申报项目最终目标。
药政部拥有一支技术与注册经验丰富的团队,作为一家提供专业服务的公司,在原料药登记、仿制药一致性评价、仿制药注册、新药注册以及进口药品注册等方面均具有专业且丰富的经验,已助力成功申报多项药品注册申请,在业内具有良好的口碑。
部门坚持 “忠诚、思考、建设、承担、分享”的公司理念,不断加强人才队伍建设、提升专业能力、丰富注册经验、拓展业务范围,致力于为客户提供高效率、高质量、合规的技术服务,为保护和促进公众健康而不懈努力。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450