政策法规||CDE本周重磅工作动态概览(20.10.19-10.23)
本周国家局药审中心(CDE)出台共计7项技术指导原则试行稿出台,及有关注射剂一致性评价的重要通知。
要文目录(按公布时间顺序):
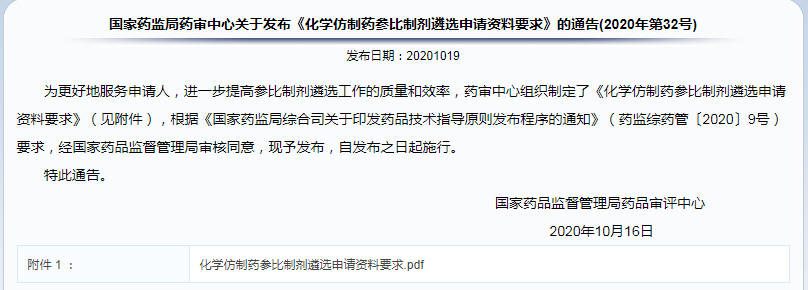
✎ 国家药监局药审中心关于发布《化学仿制药参比制剂遴选申请资料要求》的通告(2020年第32号)
✎ 关于公开征求ICH指导原则《Q3D(R2):元素杂质指导原则》意见的通知
✎ 关于注射剂一致性评价补充资料相关事宜的通知
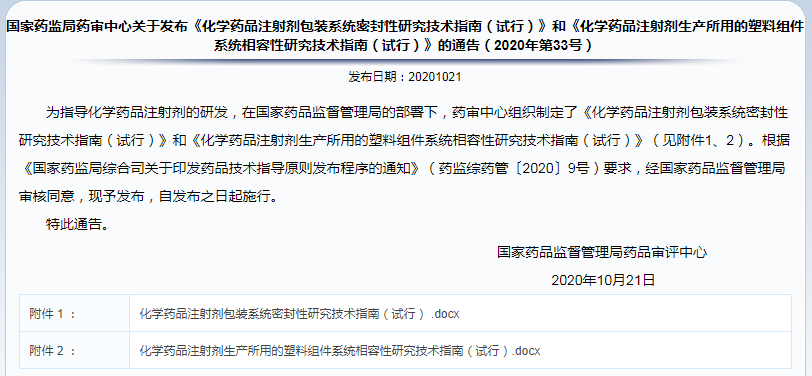
✎ 国家药监局药审中心关于发布《化学药品注射剂包装系统密封性研究技术指南(试行)》和《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)》的通告(2020年第33号)
✎ 国家药监局药审中心关于发布《中药注册受理审查指南(试行)》的通告(2020年第34号)
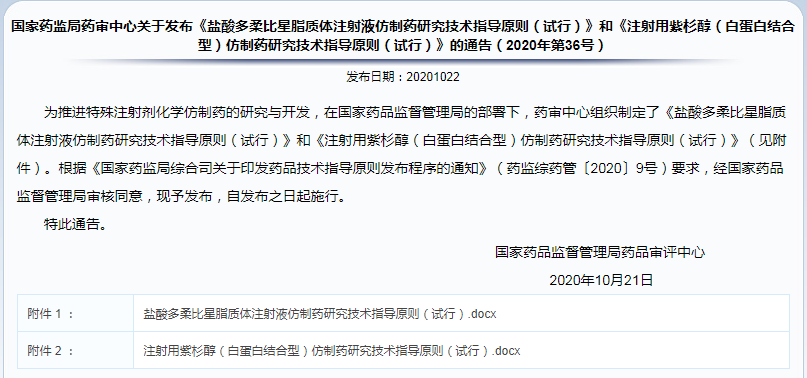
✎ 国家药监局药审中心关于发布《盐酸多柔比星脂质体注射液仿制药研究技术指导原则(试行)》和《注射用紫杉醇(白蛋白结合型)仿制药研究技术指导原则(试行)》的通告(2020年第36号)
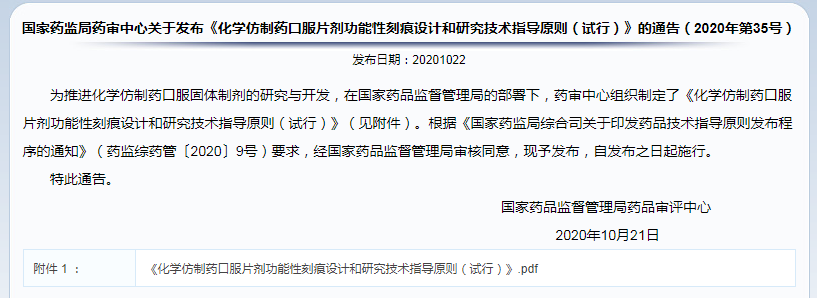
✎ 国家药监局药审中心关于发布《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)》的通告(2020年第35号)
模块1 注射剂一致性评价技术开展要求通知
注射剂一致性评价两不批准:
✦ 新增补充研究内容超80日未补回,不予批准;
✦ 补充资料存在实质性缺陷,不予批准。持有人须严格按相关指导原则完成一致性评价研究后,再行申报。

模块2 指导原则公示
01
更新《化学仿制药参比制剂遴选申请资料要求》,要求详细论述参比制剂上市背景、安全有效性、可及性等,保障参比制剂选择的合理性。
02
基于安全性考虑,纠正金、银和镍PDE。

03
注射剂包装系统密封性研究指南、生产所用塑料组件系统相容性研究技术指南试行稿正式公布,相比2020.6征求意见稿,无任何变化。结合近期注射剂品种发补通知要求,须按最新技术标准开展密封性和相容性的补充研究,保障新增研究资料在80日内如期递回。
04
两注射剂品种各论予以发布。
05
口服片剂功能性刻痕设计和研究技术指导原则发布,技术标准要求同FDA。
模块3 受理指南
根据《国家药监局关于发布<中药注册分类及申报资料要求>的通告》(2020年第68号),对应申报资料受理审查指南本周予以发补并实施。
-END-
关于我们:
药政部是隶属于公司副总裁直接领导下的部门,以国家药品政策为导向,以为客户提供集药物研发、注册申报、现场核查等一体化专业技术服务为宗旨,以高效、成功申报项目最终目标。
药政部拥有一支技术与注册经验丰富的团队,作为一家提供专业服务的公司,在原料药登记、仿制药一致性评价、仿制药注册、新药注册以及进口药品注册等方面均具有专业且丰富的经验,已助力成功申报多项药品注册申请,在业内具有良好的口碑。
部门坚持 “忠诚、思考、建设、承担、分享”的公司理念,不断加强人才队伍建设、提升专业能力、丰富注册经验、拓展业务范围,致力于为客户提供高效率、高质量、合规的技术服务,为保护和促进公众健康而不懈努力。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450