重磅:三大征求意见一夕转正, 化学药品注射剂一致性评价正式开始!
一、参比制剂选择成为注射液一致性评价的绝对前提条件
“通告”明确指出药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。尚未收载入《仿制药参比制剂目录》的品种,药品上市许可持有人应当按照《国家药监局关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)规定申报参比制剂,待参比制剂确定后开展一致性评价研发申报。
二、明确申报资料要求
《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》结合“120号文”和“80号文”的要求,明确了注射剂一致性评价资料要求,更适合注射剂一致性评价的特点。
三、明确注射剂一致性评价的时效
“通告”明确了注射剂一致性评价依然遵循《关于仿制药质量和疗效一致性评价有关事项的公告》(2018年第102号)的相关要求。根据“102号文”规定化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。逾期未完成的,企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请,经省级药品监管部门会同卫生行政部门组织研究认定后,可予适当延期。逾期再未完成的,不予再注册。需要进行一致性评价的企业需要加快脚步了。
四、特殊注射剂研究思路明确
《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》明确了特殊注射剂应基于制剂特性和产品特征,采取逐步递进的对比研究策略,通常首先开展受试制剂与参比制剂药学及非临床的比较研究,然后进行人体生物等效性研究,必要时开展进一步的临床研究。对于药学研究、非临床研究和临床研究都有了比较明确的要求。
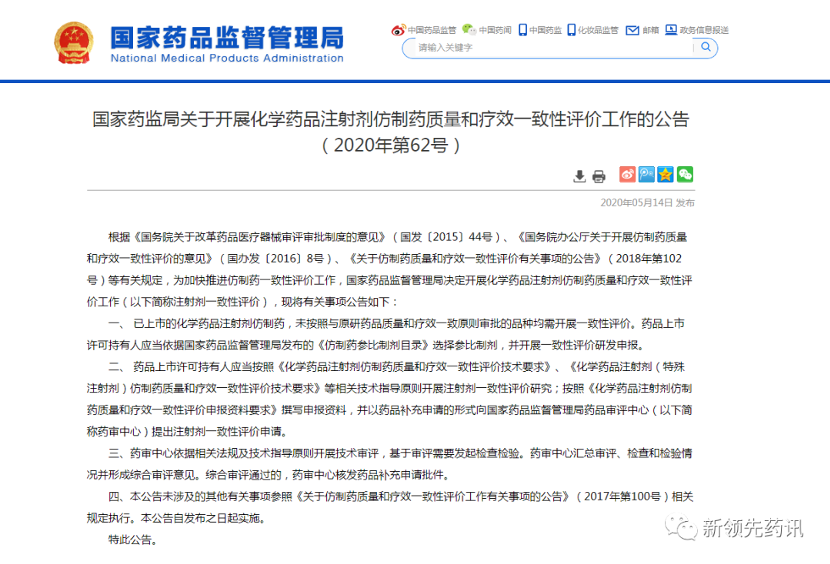

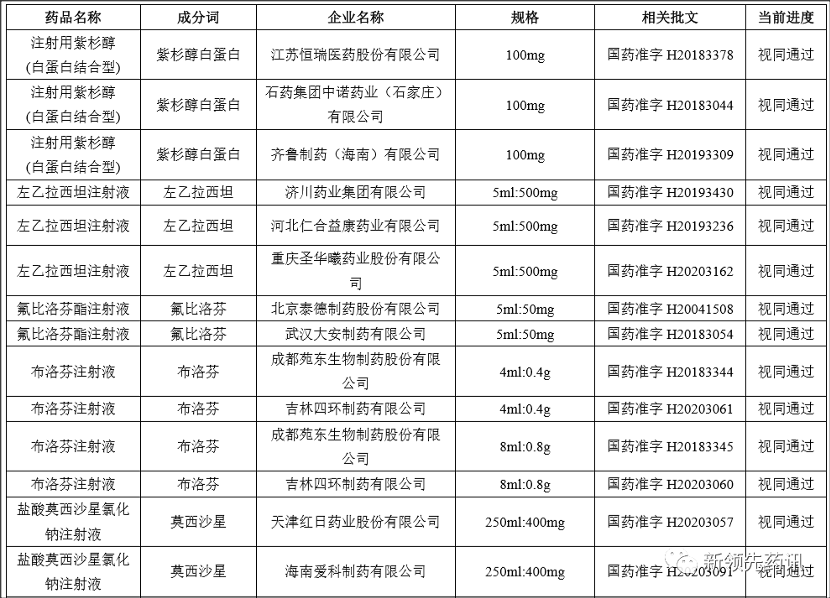
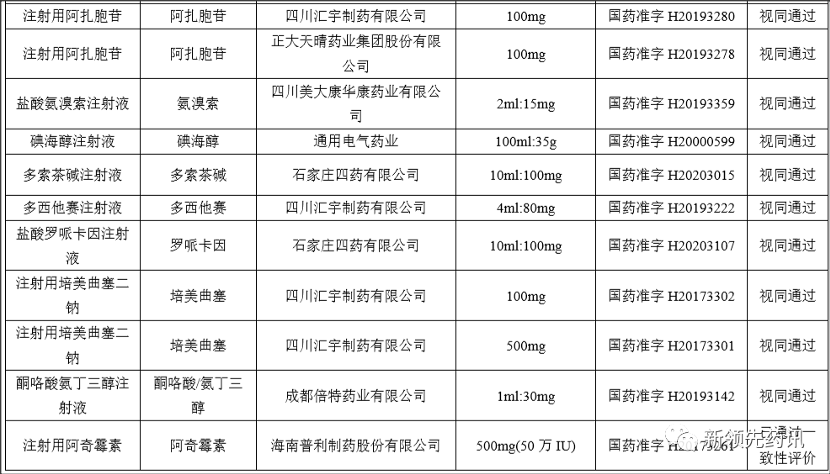
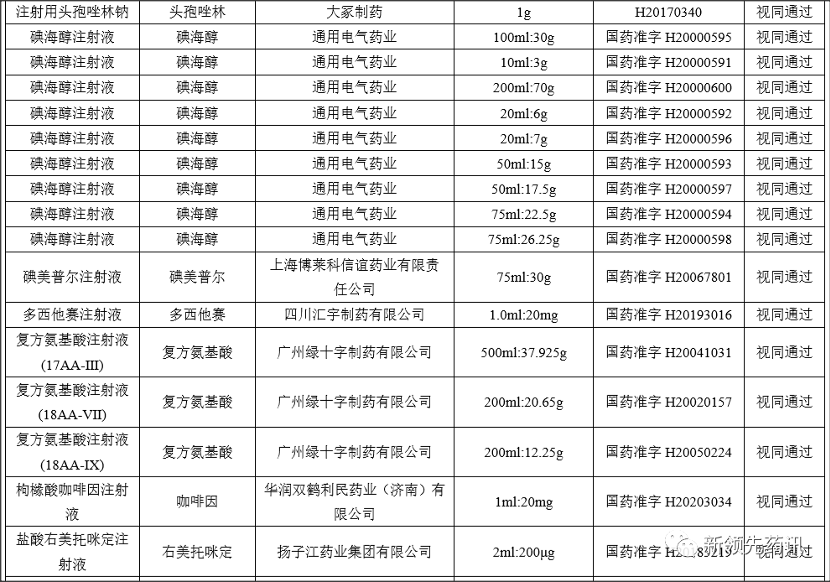
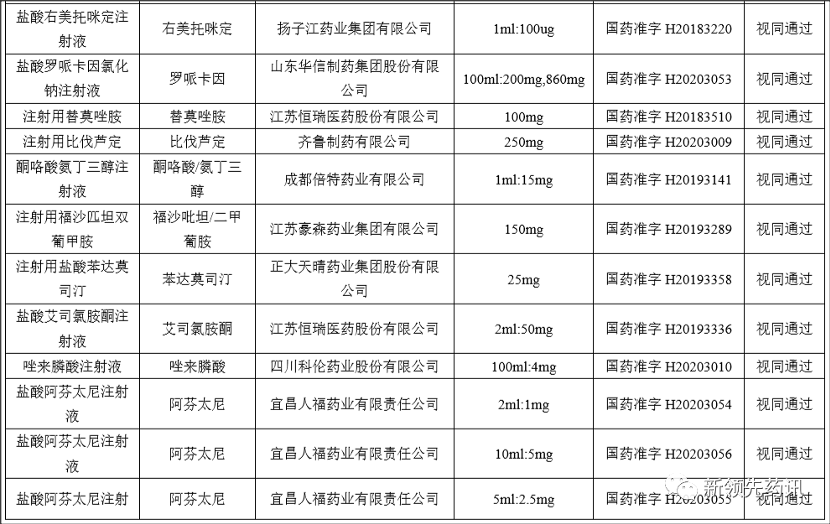
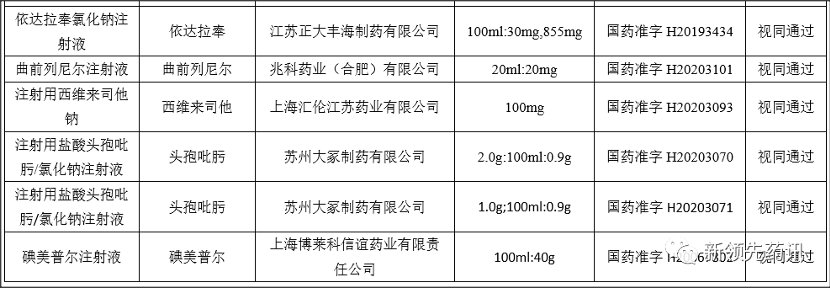
附件:化学药品注射剂一致性评价进度
转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450