浅析口服固体制剂生物等效性的影响因素
口服给药是药物最为常见的给药形式,相比于静脉注射、皮下注射、肌肉注射以及吸入等给药方式来讲,口服途径给药具有药物服用方式的便利性、也具有良好的患者依从性、最重要一点是具有大规模产业化的简易性和可操作性。但尽管有这些优点,口服制剂的发展仍然面临着一些挑战,这些限制性的方面主要来自于药物较差的溶解性和渗透性,自然地,药物的吸收也会因其不良的理化性质而受到限制。另外由于口服固体制剂经由肠胃道吸收,不可避免地会引起一些肠胃道的局部刺激和恶心反胃等情况。此外,药物在机体内的生物基质稳定性,生理学屏障阻碍,以及一些转运蛋白和代谢酶的作用也会对药物体内的吸收分布造成影响。
生物等效性试验(BE试验)是一致性评价和化药仿制药申报注册中的重要环节。BE试验多数情况下以药代动力学参数为指标,比较同种药物的相同或者不同剂型,在相同的试验条件下,其活性成分吸收程度和速度的统计学差异。最后通过血药浓度的测定与分析,比较不同的制剂在受试者体内的吸收差异性,以此来推测其临床治疗效果和制剂间的等效情况。近十年来,总局对于BE试验的管理力度和技术要求越来越严格,并逐渐趋于和欧美一致。因此,系统详实地了解口服制剂给药过程中,原辅料的理化性质,制剂工艺的细节,人体生理学特征及肠胃道渗透性能,药物的ADME过程和药物药代动力学对BE试验的影响在药物研发过程中具有重要意义。

口服固体制剂在人体内的吸收过程
想要深入了解口服固体制剂生物等效性的影响因素,必须对口服固体制剂在人体内的吸收过程做出详细清楚的了解。如图1所示,口服固体肠溶制剂在生物体内要经过崩解、分散、溶出、渗透等几个步骤,才具备被生物机体吸收的前提条件[1]。
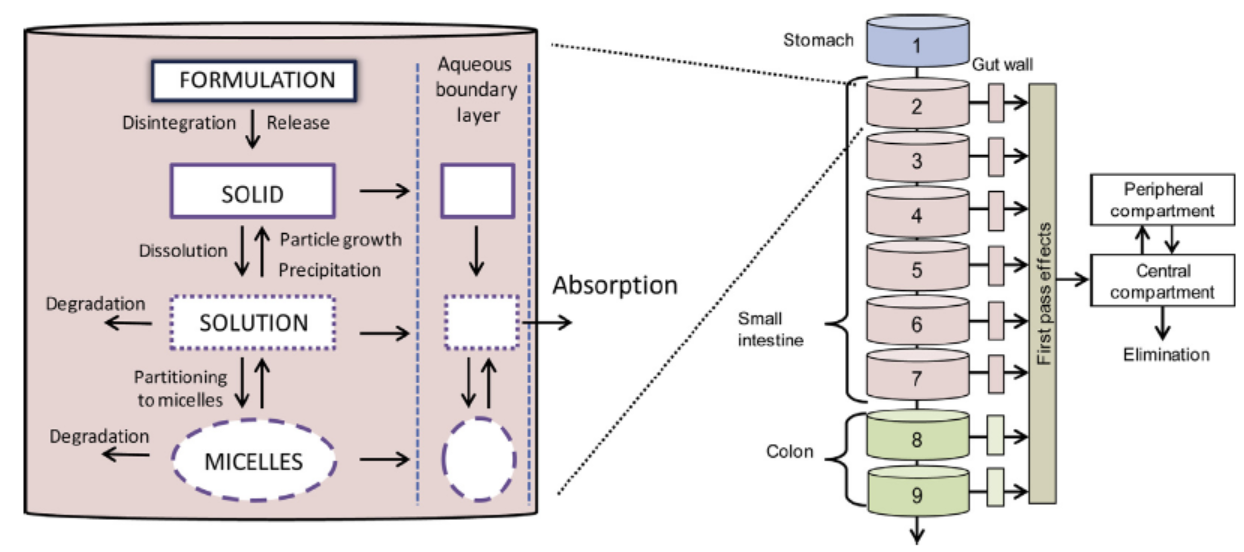
Figure1. 一般固体肠溶制剂在人体内的崩散溶渗过程
一般地,药物API分子在肠腔完成崩散溶渗等过程之后,它们会通过小肠绒毛上皮细胞被吸收[2]。如图2所示,该步骤中,小肠绒毛上皮细胞对药物粒子的吸收方式主要取决于API粒径的大小、其分子量大小和其表面的官能团和化学结构特征。粒径在100到500纳米的API粒子一般经由细胞内吞作用或者细胞摄取的方式进入细胞。
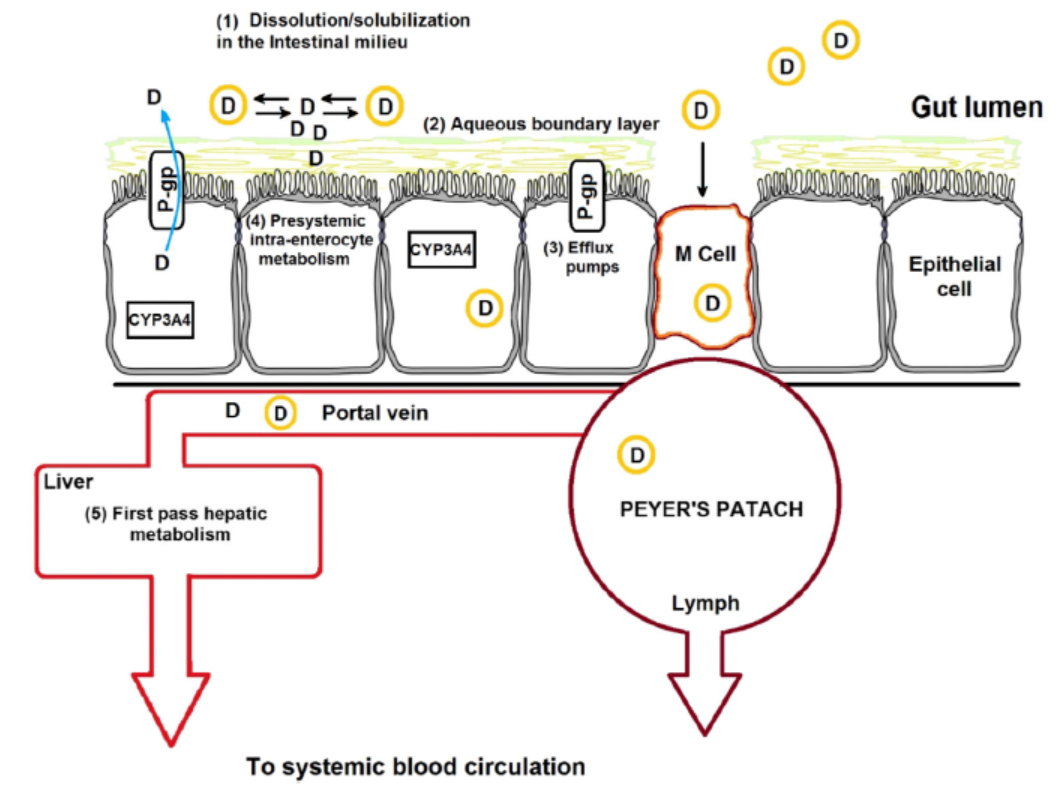
Figure2. 一般固体肠溶制剂在人体内的跨膜转运过程
以上汇总解释了口服固体制剂吸收过程的两个限速步骤,即,药物溶出步骤和跨膜转运步骤。以上两个步骤跟API的分子量、脂/水溶性、以及人体生理学状态紧密相关。药物溶出足够快时,跨膜转运是药物吸收的限速过程,但当药物溶出较慢时,药物的溶出释放可能成为药物吸收的限速步骤。
药物在人体内ADME过程的影响因素
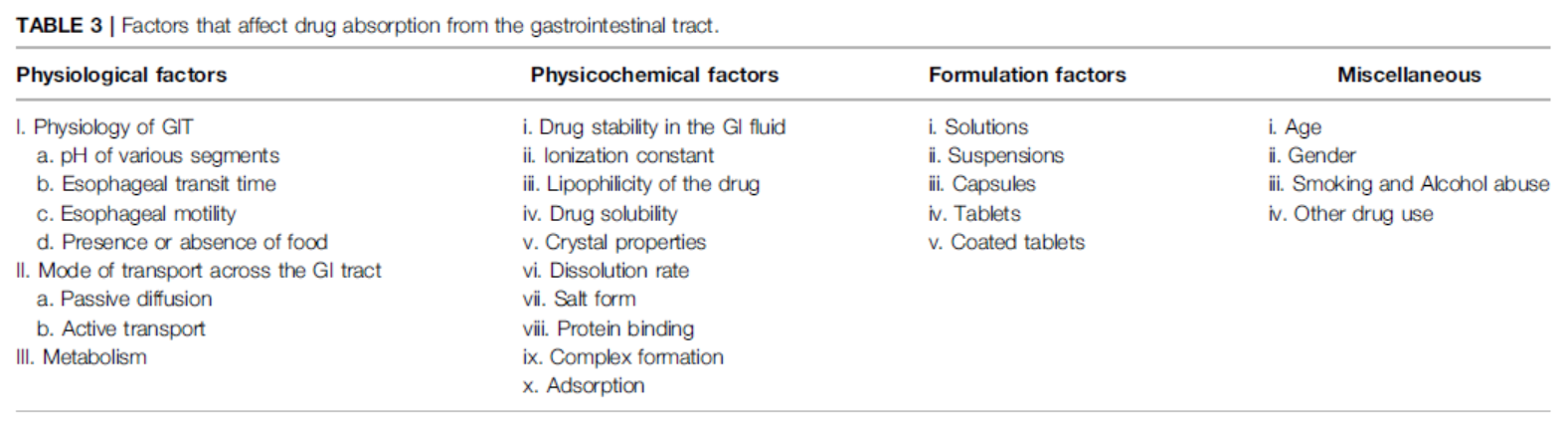
Figure3. 影响小分子药物体内吸收情况的因素汇总
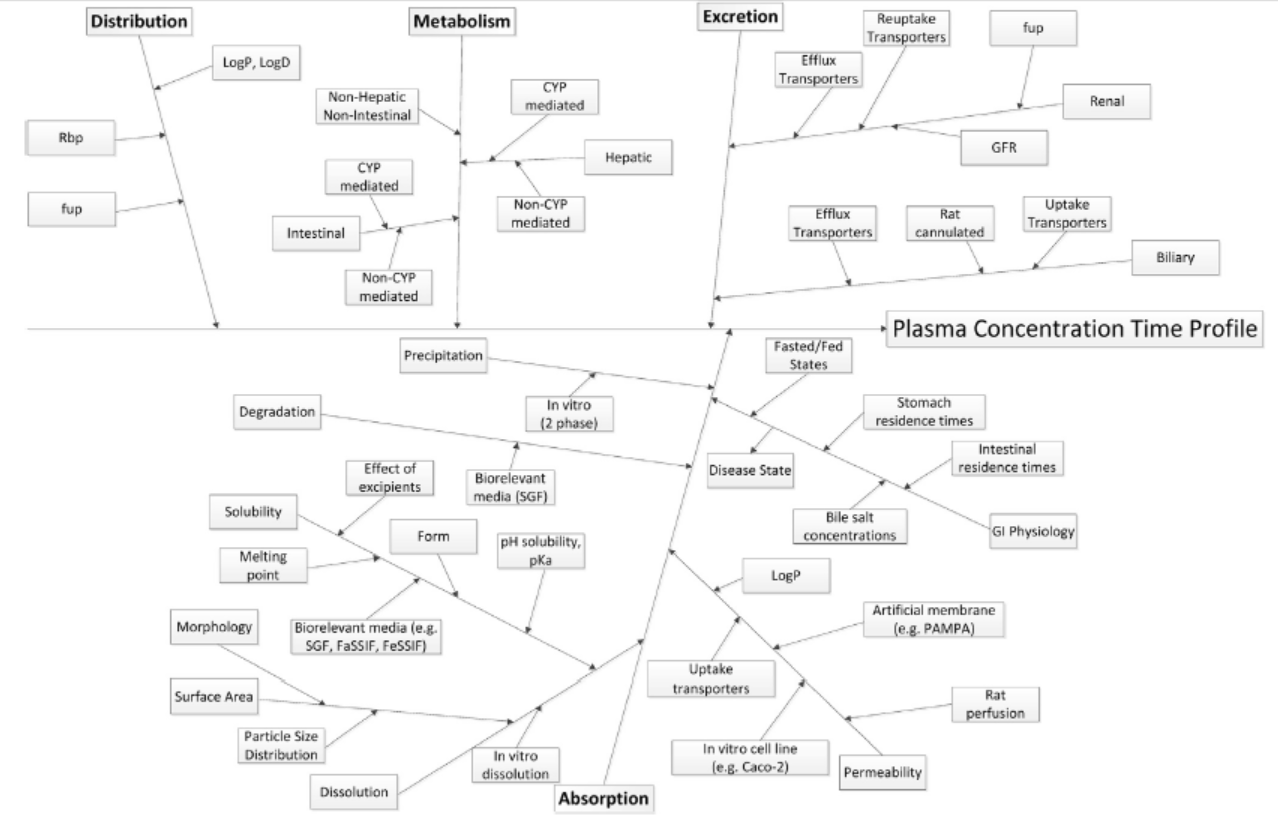
Figure4. 药物在人体内ADME过程的影响因子
在固体制剂药物吸收过程分析中,我们可以总结得到,影响其吸收的主要因素包括人体生理学特征,药物原辅料的理化性质,和制剂工艺三个主要方面的因素,此外受试者年龄,性别,种群和其他因素也会对药物的体内吸收行为发生影响。如图3,Mohammed S.Alqahtani等科学家在文献中汇总了药物吸收过程的影响因素[2]。进一步地,Filippos Kesisoglou等科学家进行了更为详细的总结,在图4中全面汇总了药物在人体内吸收,分布,代谢,排泄全命运周期的关联因素和影响因子[3]。
生理学因素与食物的影响
首先,胃肠液成分与性质对药物的吸收存在显著影响,肠胃道pH值的变化,会影响小分子药物的解离状态,这对于许多小分子化合物的吸收至关重要。胆汁中的的胆酸盐对难溶性药物有增溶作用,从机制上来讲可以促进吸收。其次,胃排空速度的快慢,对药物的吸收也有影响。绝大多数药物在小肠中吸收,那么胃排空加快,药物到达小肠部位时间就会变短,吸收就会加快,生物利用度会提高。肠胃道的蠕动可使食物与药物充分混合,小肠的固有运动可促进固体制剂的进一步崩解,有利于药物的吸收。
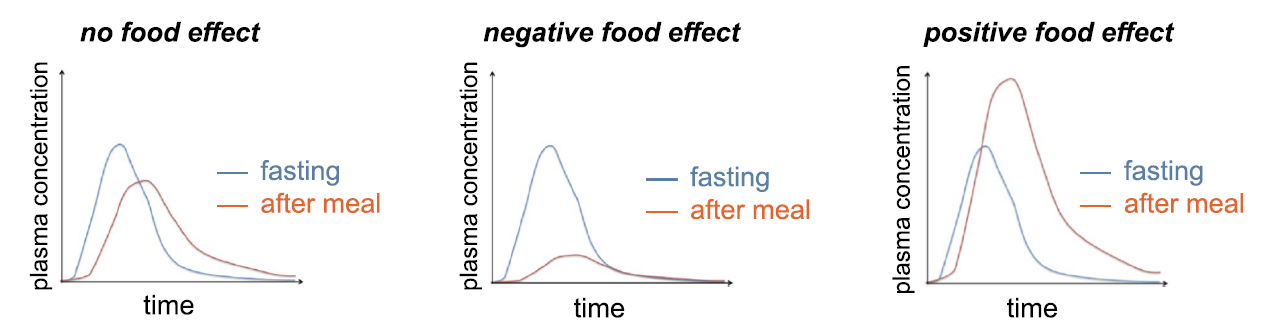
Figure5. 食物对于药物PK的影响
提及生理学因素对药物吸收的影响,不得不提到食物对于药物吸收的影响。如图5所示,揭示了食物对于PK的三种影响状态[4]。食物对于药物吸收的影响机制较为综合,涉及肠胃道pH值的变化,胆汁分泌,胃排空时间和肠胃蠕动等方方面面。具体影响如下:食物改变肠胃道的酸碱性,由于进食后胃酸或胃蛋白酶分泌增加,对于酸碱环境较为敏感的药物,会影响其溶出溶解性质,化学稳定性等特性,进一步对其药理药效产生影响。高脂肪食物会降低胃肠道动力,从而减慢胃排空速率,食物改变胃肠道动力之后,对药物的吸收会产生影响。另外,高脂餐也可以促进胆汁分泌,增加血液循环。也有研究表明,食物中的特殊蛋白质可与部分药物结合成盐,形成药物蛋白复合物结构,致使药物体内吸收分布情况发生变化,或使得减少吸收,降低生物利用度达不到治疗效果,或使得吸收增强,血药浓度超过最低毒性剂量浓度。
原辅料理化性质的影响
1. API性质
谈及API性质,应首先关注API的粒径分布情况。一般来讲,API粒径越小,比表面积越大,药物的溶解溶出速度越快。所以为达到增加难溶性药物吸收目的,可采用药物微粉化技术,降低药物粒径提高比表面积。对于难溶性药物来讲,普通工艺的片剂可能存在批间溶出重现性差、生物利用度变异较高的问题,进而直接影响临床效果, 通过降低API的粒径,可使API含量更为均匀,药片更为细腻。
药物的晶型会影响其溶出速率,进而影响药物的体内吸收,在不考虑其他因素下的情况下,溶出最快的是无定形态。虽然无定形状态溶出较快,但可能会在贮存或稳定性期间发生晶型的转化,改变其溶出性质。有些多晶的品种在稳定性期间发生溶出变慢的情况,有可能是发生了转晶的情况。在固体制剂加工过程中,应对晶型问题予以足够的重视。
成盐的策略对药物溶出也有影响,难溶性化合物成盐后,溶解度增加,能够在消化道中迅速溶解,生物利用度提高,改良其PK特征。
2. 辅料性质
辅料称为非活性成分。但是,辅料可以影响药物的吸收、分布、代谢和排泄过程。研究表明,辅料对药物的溶解度,溶出,渗透性,吸收等性质均有影响。添加功能性辅料的目的在于改善制剂的稳定性、控制药物释放、便于工业化大批量生产等。合适的辅料选择可以调节药物释放情况、解决制剂稳定性、生产可行性、设备匹配性等诸多问题。但是辅料的使用预期往往只能改善其中某一个方面,所以经常需要在几个面临的问题之间做一些平衡,采取一定的工艺策略解决这些问题。
总的来讲,辅料对于药物制剂的溶解溶出影响较为复杂,不同辅料的作用机理机制也不尽相同。值得一提的是,有些辅料可以导致API晶型的转变。一般认为辅料对BSC I类药物溶出影响较小,对BCS III类药物的溶出影响有限,对于BSC II类和BCS IV药物来说,辅料对溶出影响较为显著。
工艺与制剂的影响
原辅料的理化性质可以影响口服固体制剂的吸收,溶解度大、分子量小的药物溶出和吸收较快。同种药物的不同剂型,其吸收也有较大的差异。一般来讲,缓释制剂溶出和吸收慢于片剂慢于胶囊剂。
那么,对于剂量和剂型相同的同种药物,因制剂工艺的不同,药物吸收速度和程度也会有明显差异。如图6的汇总所示,采用不同的工艺技术对不同BCS分类药物进行制备后,各药物的药代动力学特征会有显著改善[2]。
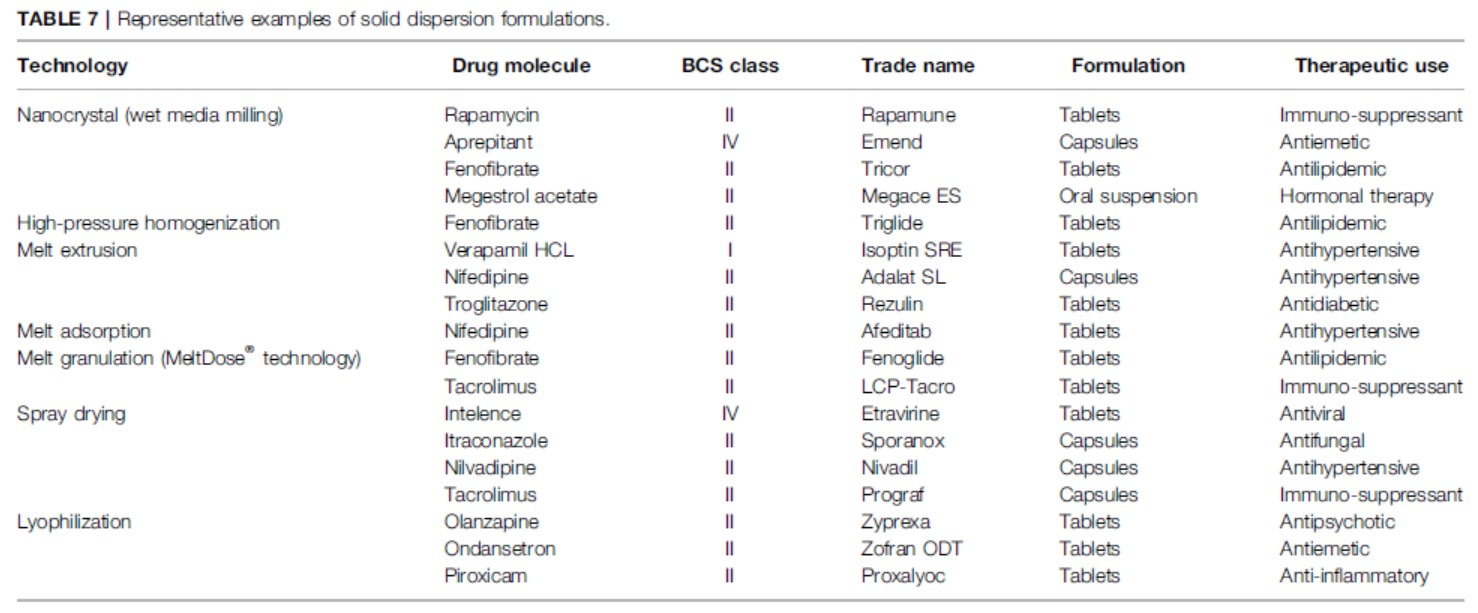
Figure6. 工艺与剂型对于药物PK的影响
思考与后记
综上所述,药物的口服吸收取决于药物API的溶解度、粒径、晶型、渗透性和辅料的性质以及人体胃肠道的生理学特性和食物摄取情况等等因素。这其中的每个因素都影响药物的释放,吸收和药代动力学性质。在药物研发过程中,一般采用体外溶出实验获取溶出数据,后使用Gastroplus软件进行以生理学为基础的药代动力学(PBPK)建模,对药物的吸收情况进行评价预测。
在进行口服固体制剂的溶出实验时,溶出介质,原辅料理化性质等等因素都需要进行充分研究,来保证自制品与自制品批次间,自制品与参比批次间的溶出行为和品质的一致性,为临床生物等效性试验的开展奠定前期良好基础。
参考文献:
北京新领先建立有体内外桥接平台,致力于将体内行为与体外行为进行桥接,利用软件建立体内外相关模型,明确药学开发目标,预测BE成功率,缩短药物研发时间,节约产品开发成本,为客户每个项目顺利申报提供保障。
本平台也针对客户在BE试验设计和结果所遇到的问题,提供技术支持,并提供合理、科学的建议。后续着重模型开发,扩大模型应用,为新药研发提供科学依据。本平台拥有或计划拥有全球应用最广泛的模型模拟软件和药动学分析软件,包括DDDPlus、ADMET predictor、Gastroplus、DAS、PASS、Phoenix WinNonlin等多种软件。
已经成功对近200个口服固体制剂项目开展了包括药学目标设定、预BE及正式BE的预测和结果分析解读等研究工作,其中进入到BE阶段的近百个项目,一次性通过率超过80%。此外,平台还对外承接了几十个BE预测及结果分析解读的项目,均精准剖析了客户于BE试验过程中存在的问题,并提供了合理完善的指导方案。
体内外桥接平台负责人为hemanth Joshi先生,曾担任世界排名前十通用名药企Dr.Reddy‘s Laboratories、Sun Pharmaceuticals等公司的高级科学家,拥有近20年的药物制剂研发及临床评价经验;曾参与几十个FDA、EMA注册ANDA、505b(2)的研发工作,其丰富的工作经历和卓越的工作能力,带领新领先医药研发水平更上一层楼。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450