临研解读 | 临床试验数据监查委员会(DMC),一文读懂!
✎ 确证性临床试验,多国家、多中心、大样本的试验;
✎ 观察周期长的临床试验;
✎ 安全性风险高的试验;
✎ 治疗针对的是危及生命的疾病,受试者是死亡风险较高的人群;
✎ 受试者中可能存在弱势群体;
✎ 创新药,之前的数据显示了革命性的疗效,期待可因药物有效而提前终止的临床试验。
DMC由主席和一般成员组成,至少包含3名成员(含主席),DMC成员的选取应具有代表性、公正性、独立性,同时与相关方无利益冲突。
✎ 代表性:DMC成员是来自于不同学科的专家,根据试验的特殊需要邀请临床专家、统计学专家、毒理学、流行病学、药学或医学伦理学等方面的专家来审阅研究中的试验数据。
✎ 公正性:DMC中所有成员应均有相等的权利发表自己的看法,提出个人建议。注意,DMC 给出的建议最好通过达成内部共识而非简单投票的方式。
✎ 独立性:DMC成员不得在项目研究团队中任职或担任顾问,仅与申办者保持必要的联系。
✎ 利益冲突:DMC成员与临床试验相关方无财务利益、学术利益及其他利益冲突。
DMC主要依托于其特有的会议程序展开,按照会议类型分为DMC的启动会、计划的数据审核会和计划外会议。
DMC启动会应在首例受试者入组前召开,参会人员包含但不限于所有DMC成员、项目研究团队和独立统计团队。
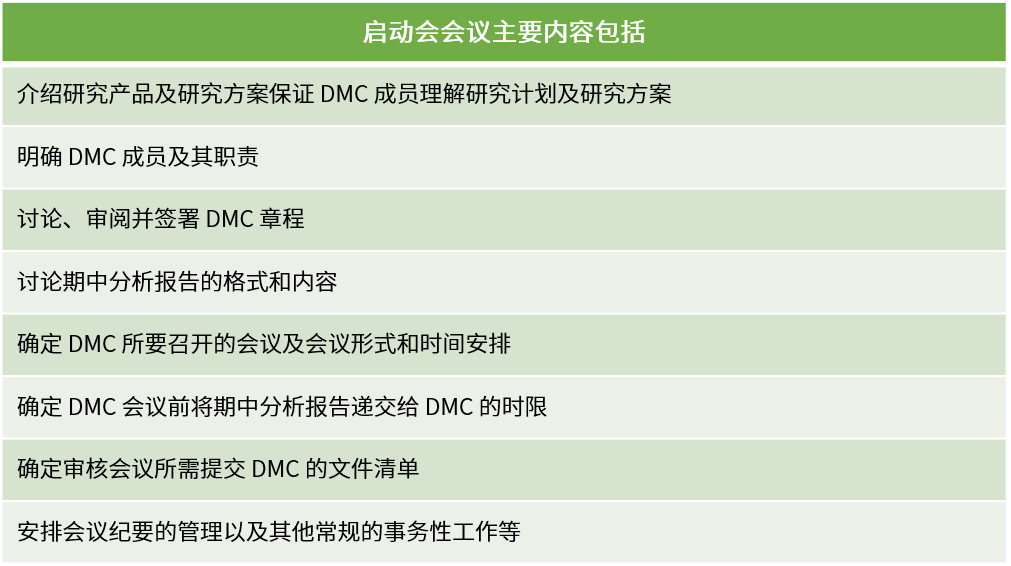
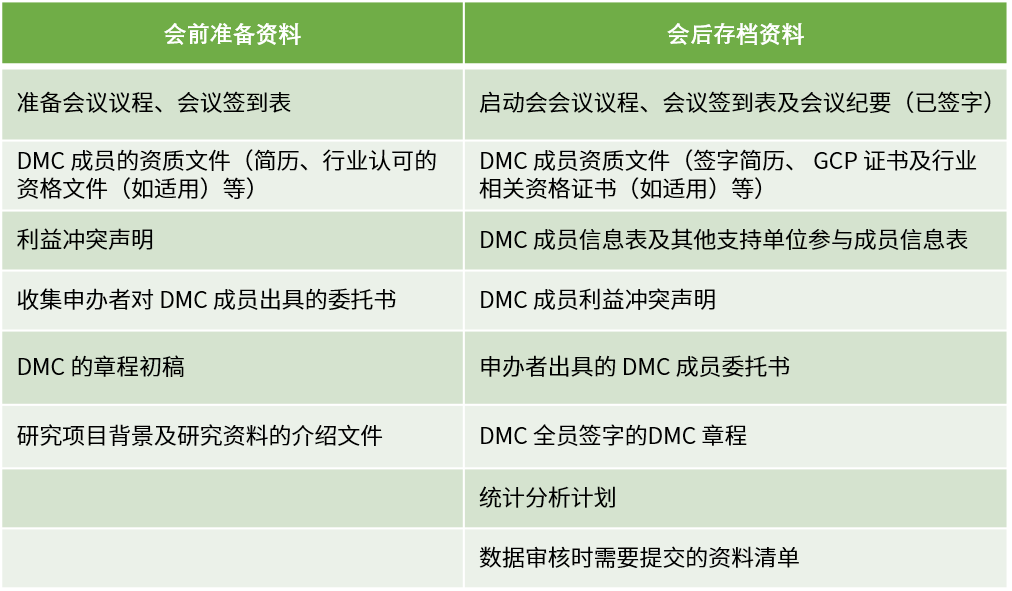
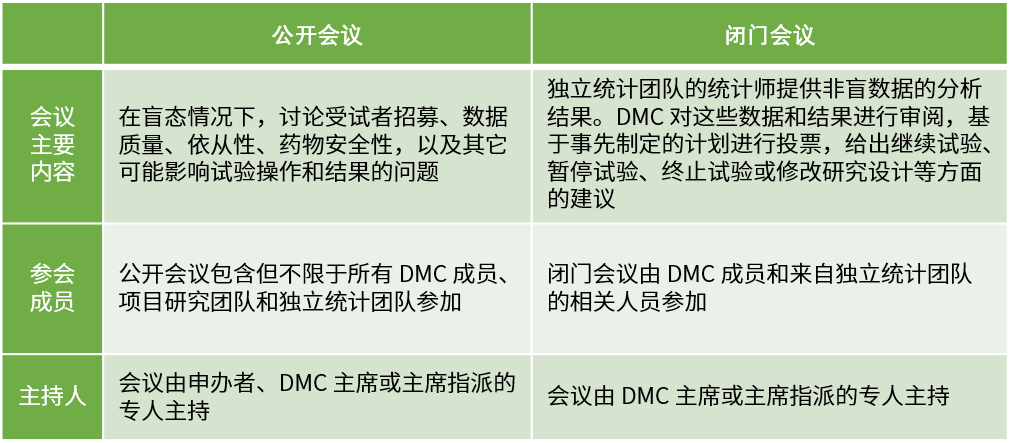
计划会议需要按照根据DMC章程规定的频率、形式开展,通常根据 DMC目的以及试验预期入组率、事件发生率、随访期等执行情况而定。DMC会议分为公开会议和闭门会议两种形式。
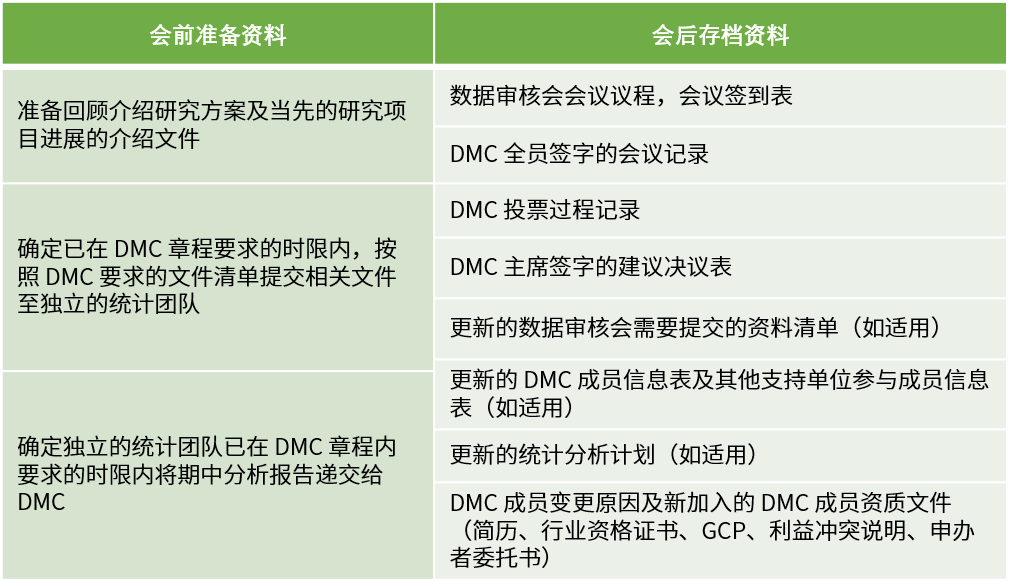
计划外会议的准备、召开、存档资料参考计划会议的流程,会议纪要中需要详述召开计划会议的原因。召开计划外会议的几种情况如下:
✎ 基于计划审核会议的分析结果,DMC 可要求举行计划外会议;
✎ 申报者发现紧急安全性问题;
✎ 其他申办者或DMC认为必要的情况。
每次审核会议完成后 DMC 会根据会议过程中的决议给出专业建议,给出的建议基于安全性和有效性两个方向,包括不限于:
✎ 无需修订方案继续试验(按既定的研究方案实施) ;
✎ 修订方案后继续试验(如调整样本量等);
✎ 暂停入组直至解决不确定性问题(如潜在严重安全性问题) ;
✎ 终止试验(如基于已观测到的有效、无效或严重安全性问题) 。
当DMC因安全性问题而建议终止试验时,申办者需要及时与监管机构沟通。申办者在实施DMC关于试验设计重大修改的建议之前,应与监管机构进行讨论,以确保这些变更符合法规要求。
DMC的建议对申办者不具有约束力。如果申办者不采纳DMC关于因安全性问题终止试验的建议,应以书面形式回复,并告知伦理委员会。
在新药上市申请时,应在临床总结报告中对DMC相关内容进行阐述,包括已召开的盲态和非盲态的、计划内和计划外的DMC会议相关内容。DMC会议纪要和会上审阅的报告应作为临床总结报告的附件提交。申办者在进行任何期中数据揭盲前(最好是在试验开始前)向监管部门递交DMC章程(包括期中分析计划)。
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450