政策法规||本周重磅政策法规概览(21.09.26-21.09.30)
01
关于公开征求《化学仿制药晶型研究技术指导原则(征求意见稿)》意见的通知
扫描下方二维码
查看详细信息

关于公开征求《口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(征求意见稿)》意见的通知

扫描下方二维码
查看详细信息

关于公开征求《对我国<以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则>中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(征求意见稿二)》意见的通知

扫描下方二维码
查看详细信息

01
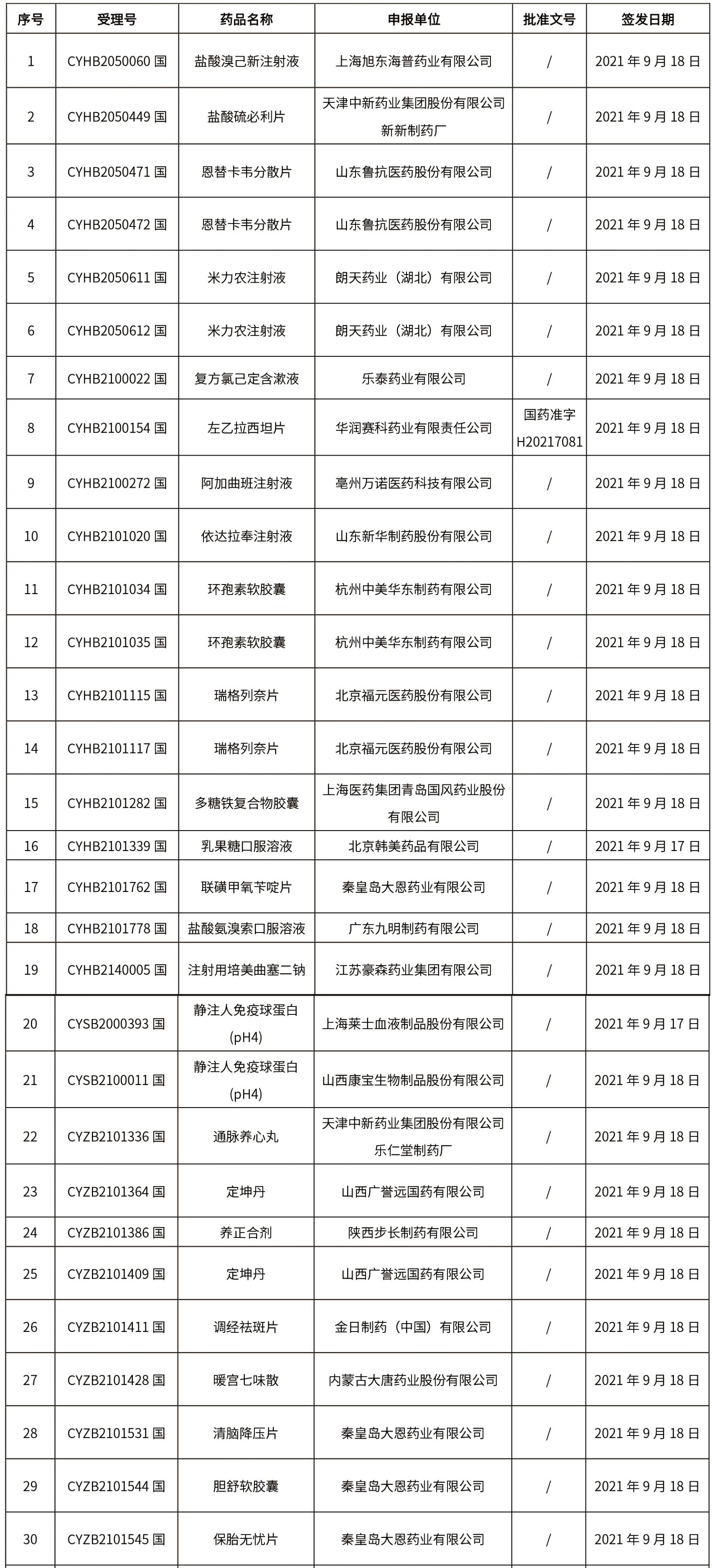
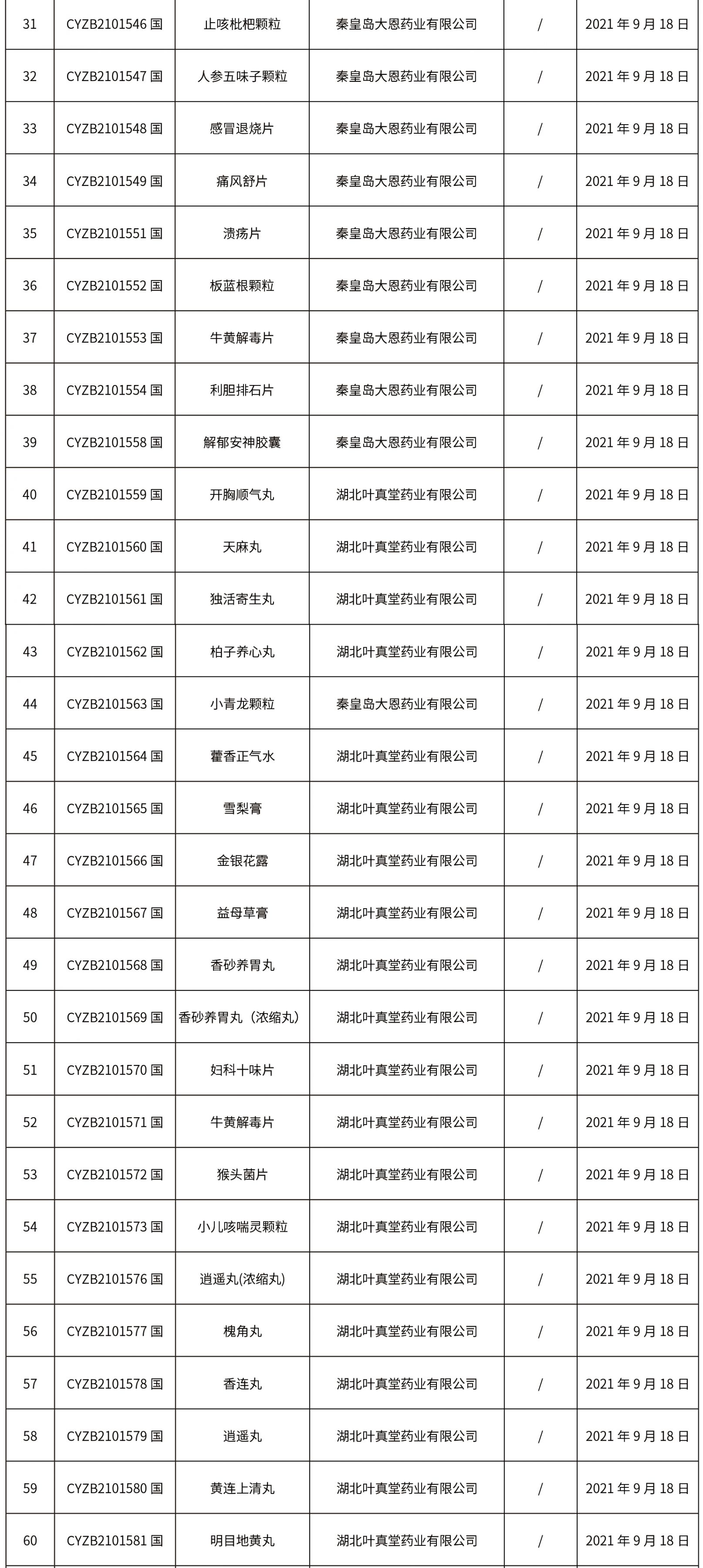
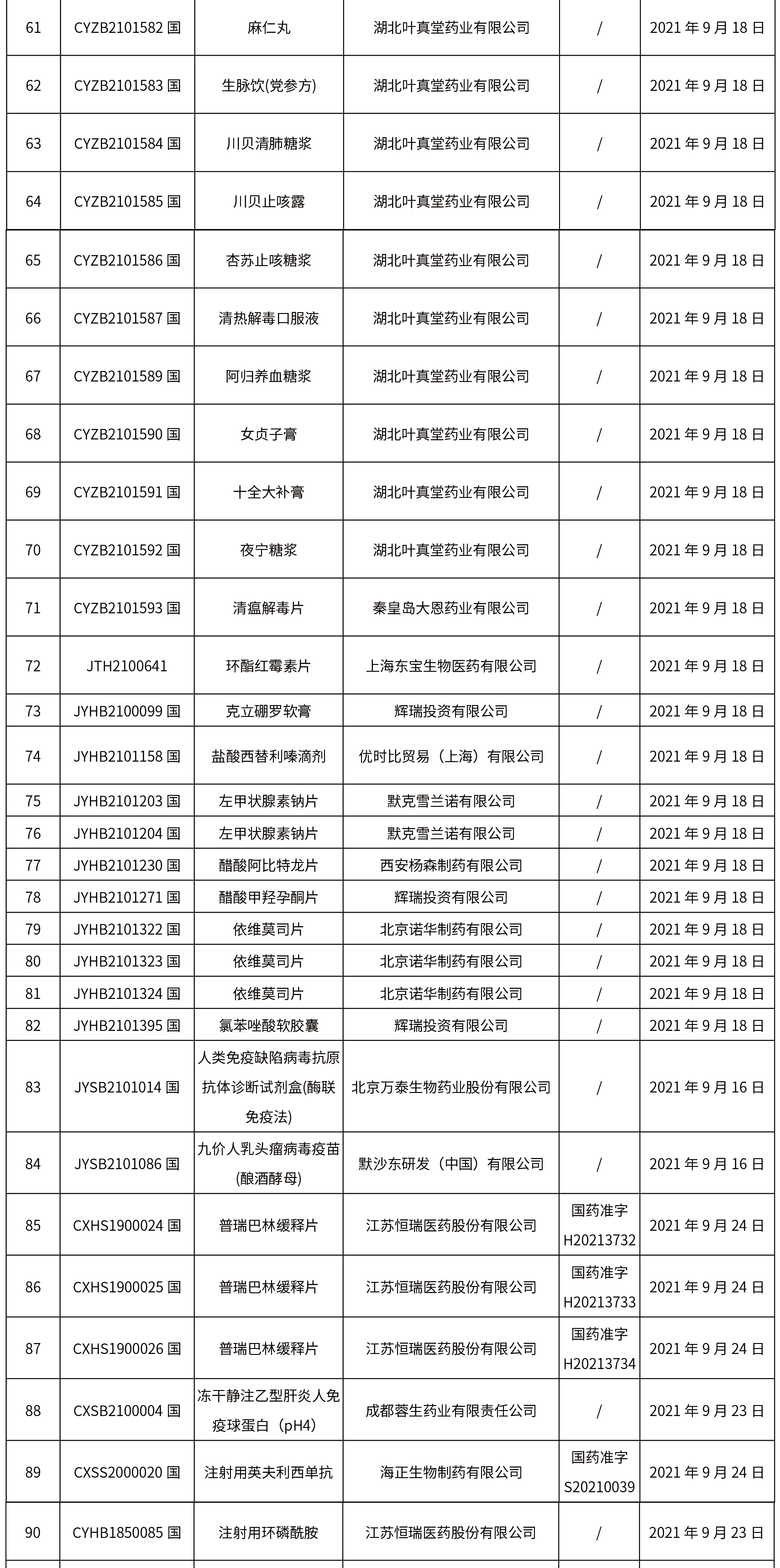
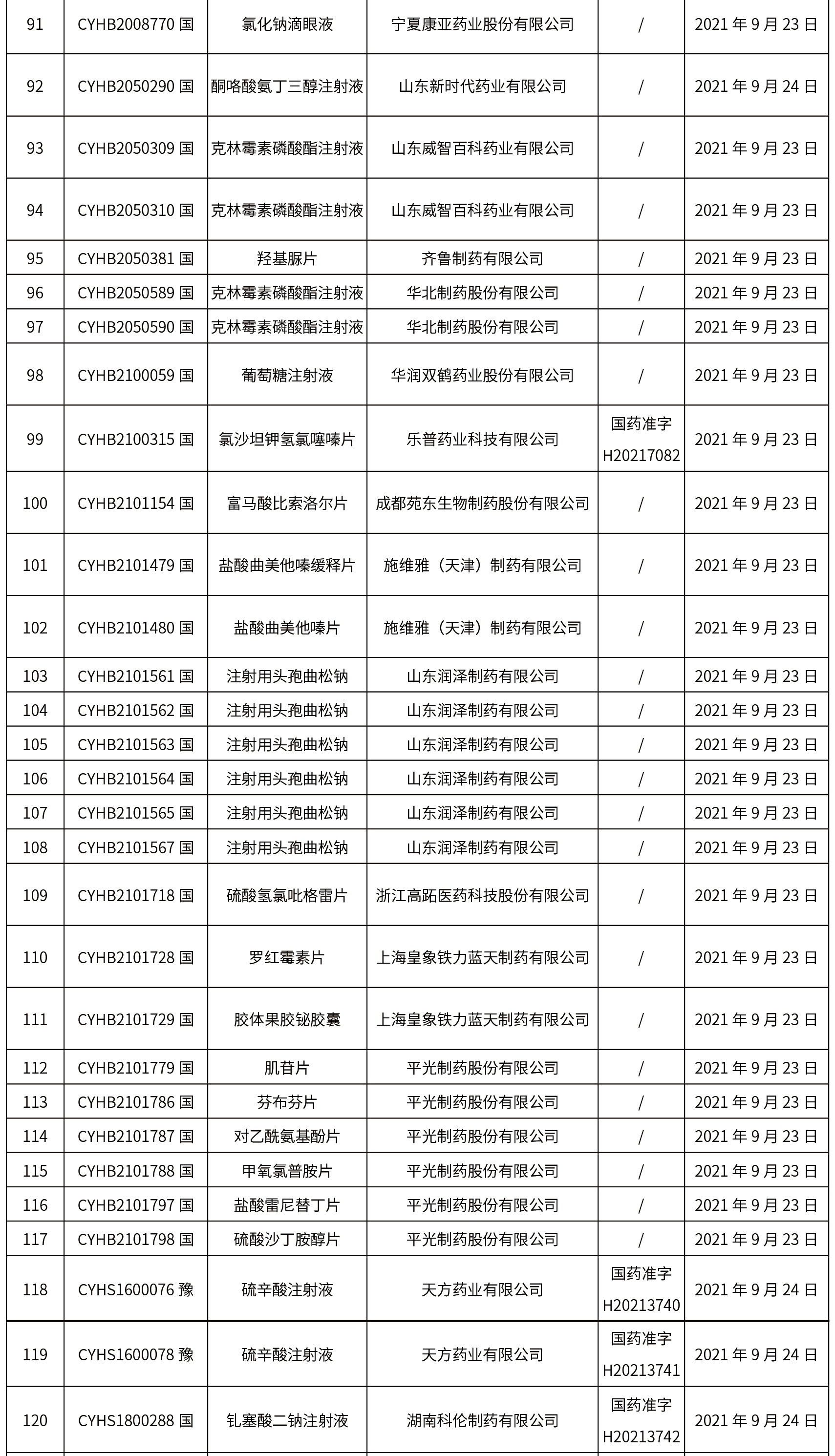
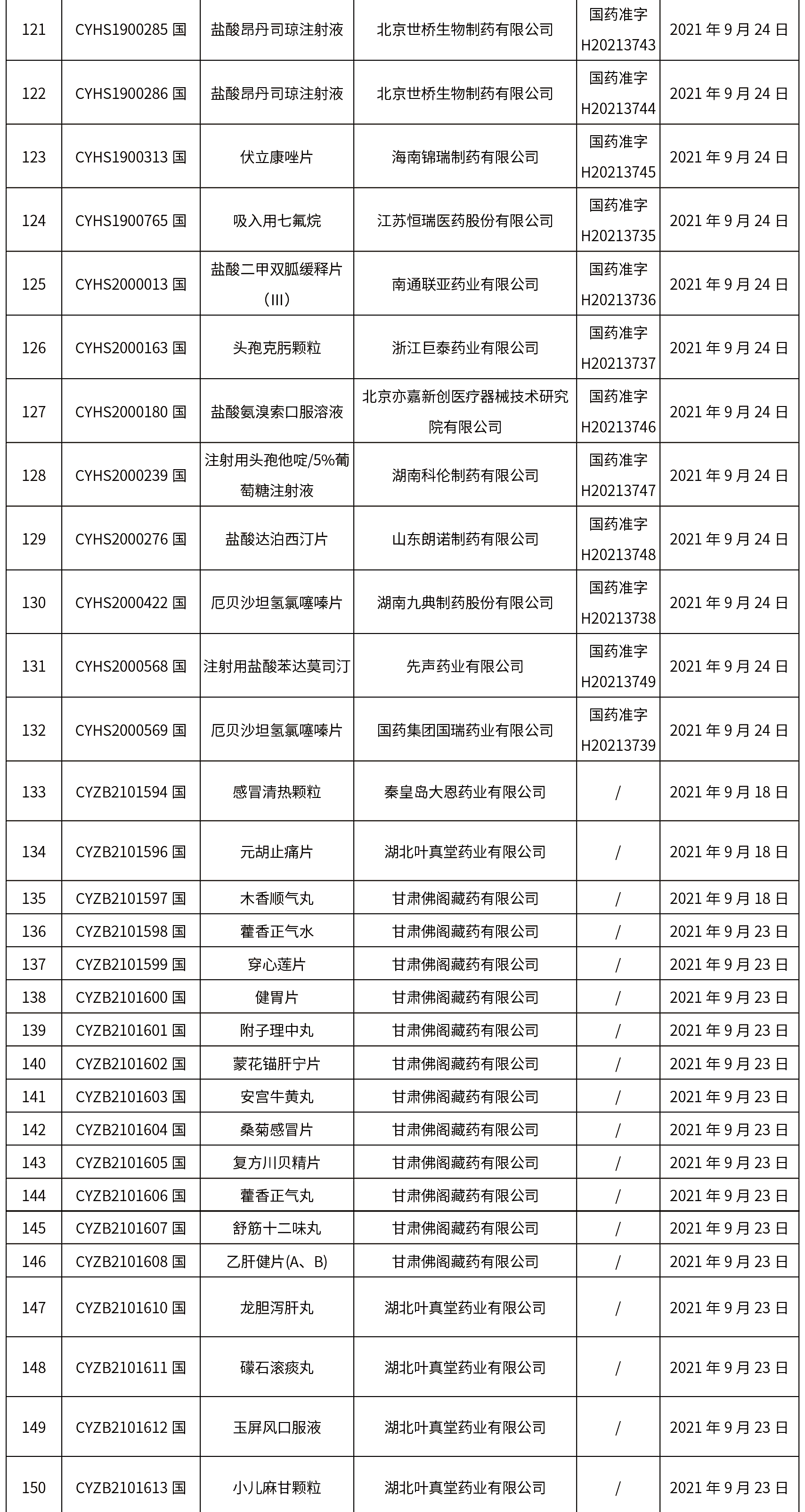
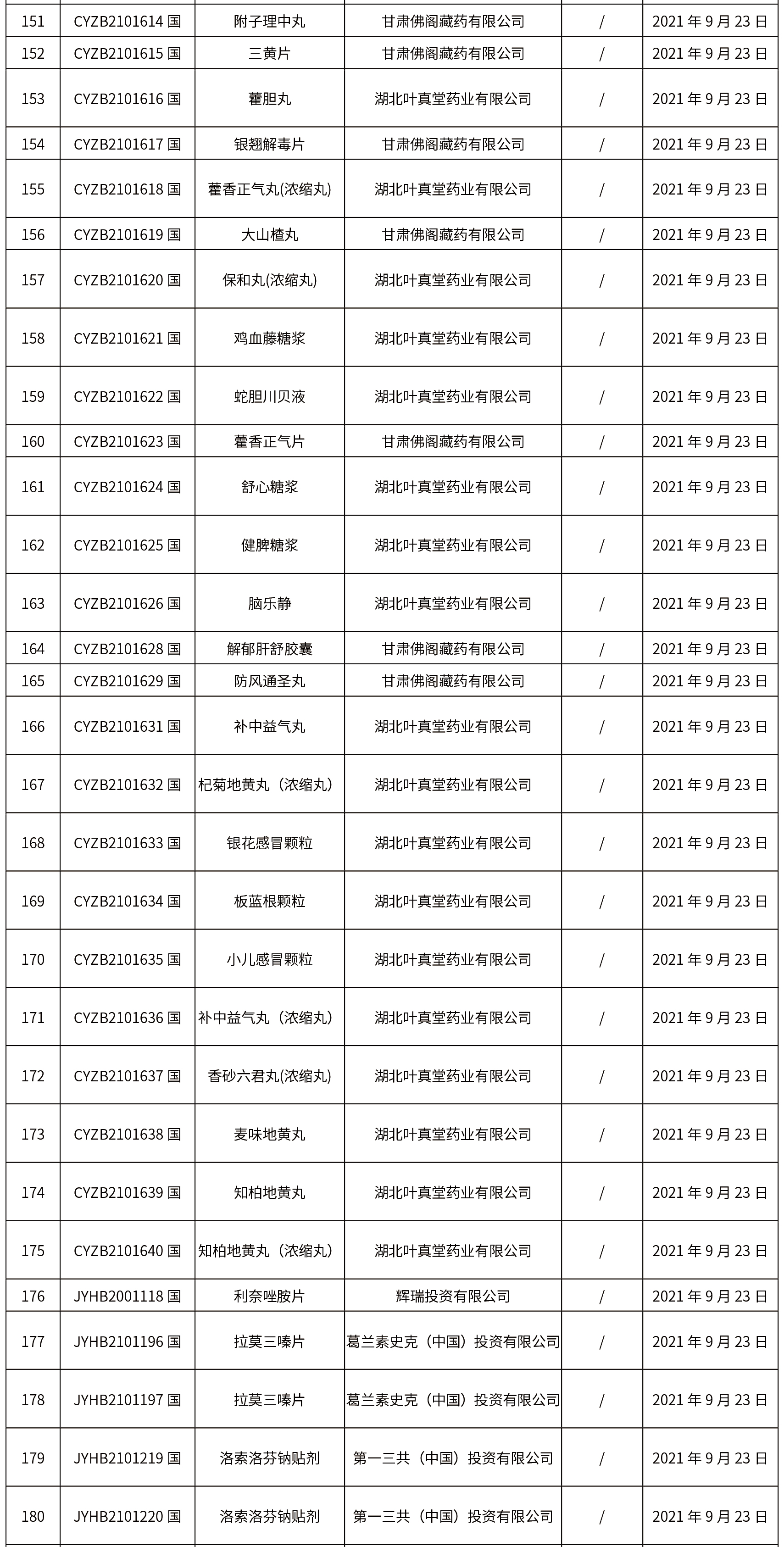
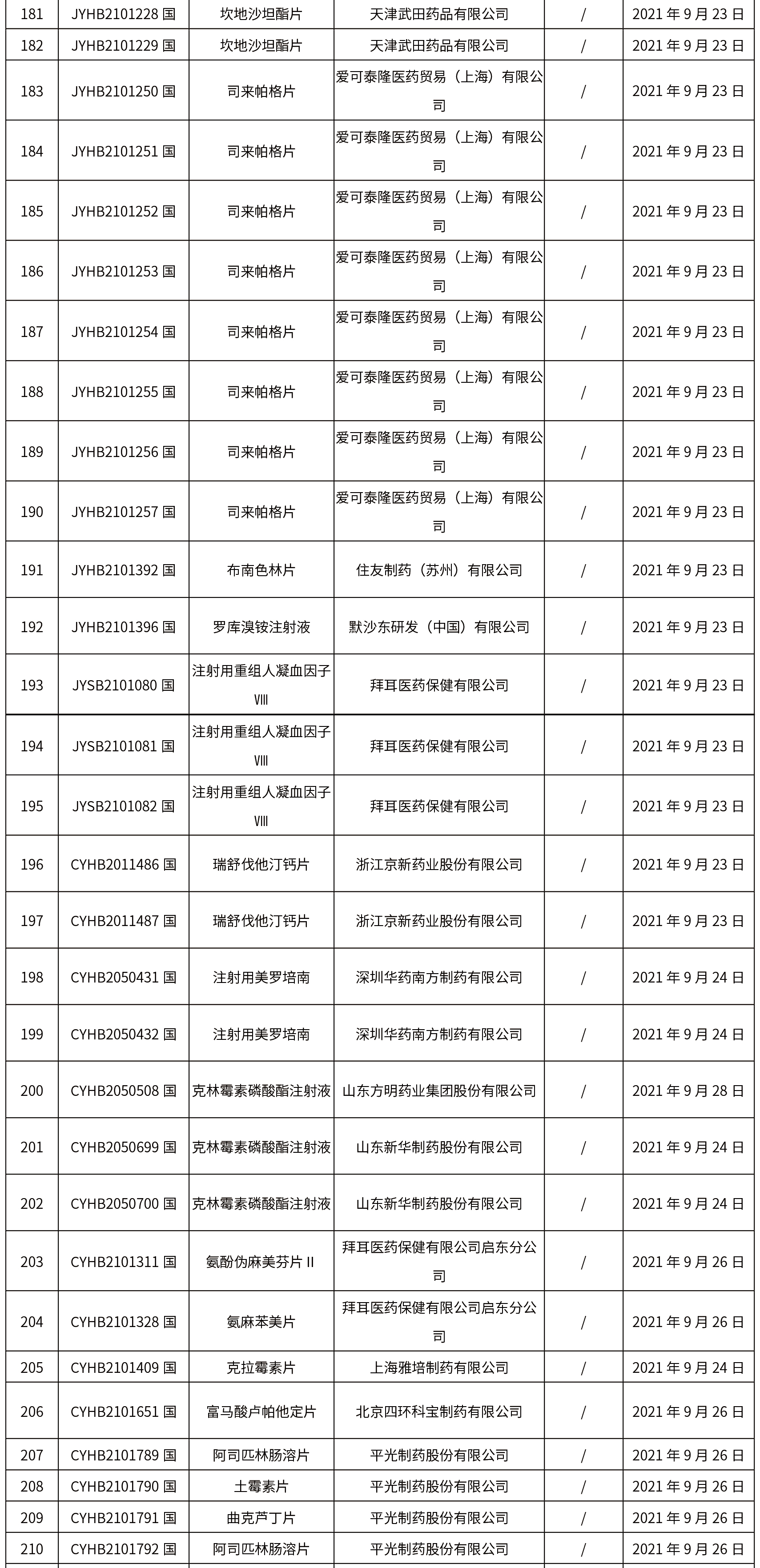
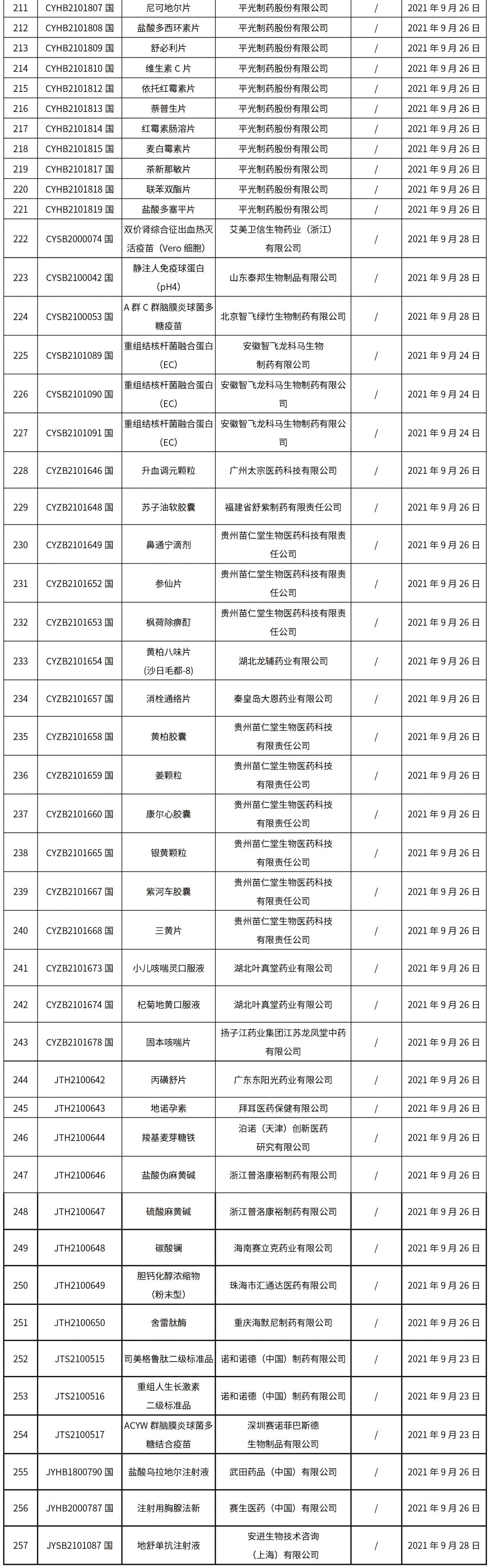
1.本周共发布了271个品规的药品批准证明文件待领取信息,其中一致性评价25个,注射剂33个。
02
关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2021年第122号)
扫描下方二维码
查看详细信息

03
关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号)

扫描下方二维码
查看详细信息

04
国家药监局关于实施药品电子通用技术文档申报的公告(2021年第119号)
扫描下方二维码
查看详细信息

05
国家药品监督管理局关于顺铂注射剂等品种说明书增加儿童用药信息的公告(2021年第118号)

扫描下方二维码
查看详细信息

06
国家药品监督管理局关于实施《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》有关事项的通告(2021年第76号)
扫描下方二维码
查看详细信息

07
国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告(2021年第73号)

扫描下方二维码
查看详细信息

08
国家药监局关于成立全国医疗器械临床评价标准化技术归口单位的公告(2021年第116号)

扫描下方二维码
查看详细信息

09
国家药监局关于芦荟珍珠胶囊处方药转换为非处方药的公告(2021年第115号)

扫描下方二维码
查看详细信息

10
国家药监局关于发布医疗器械动物试验研究注册审查指导原则 第一部分:决策原则(2021年修订版)等2项注册审查指导原则的通告(2021年第75号)

扫描下方二维码
查看详细信息

11
国家药监局关于发布体外诊断试剂临床试验技术指导原则的通告(2021年第72号)

扫描下方二维码
查看详细信息

01
药品注册申请药学研制和生产现场核查任务信息公告(2021年第22号)
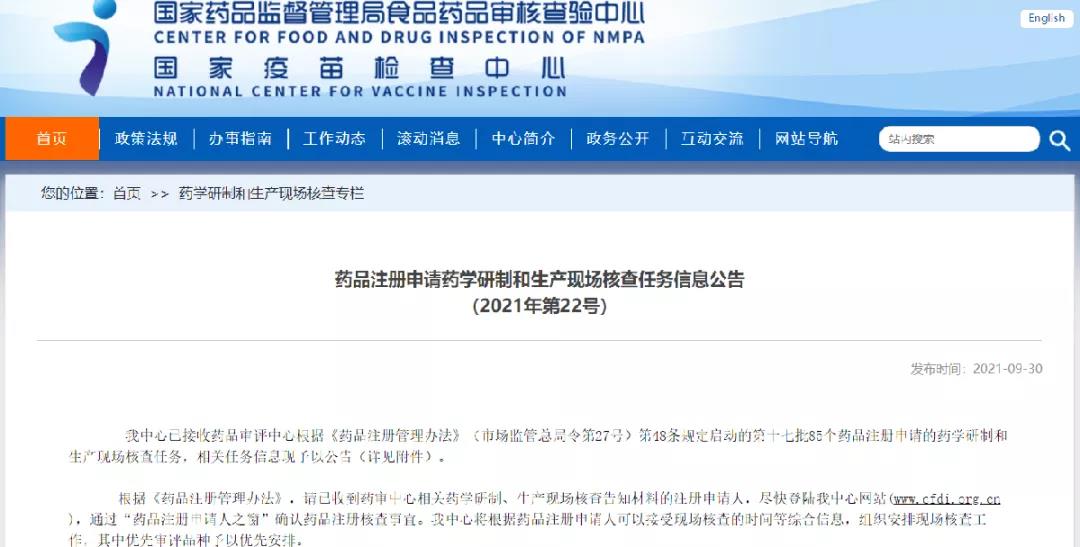
扫描下方二维码
查看详细信息

02
药品注册申请药学研制和生产现场检查任务信息公告(2021年第21号)
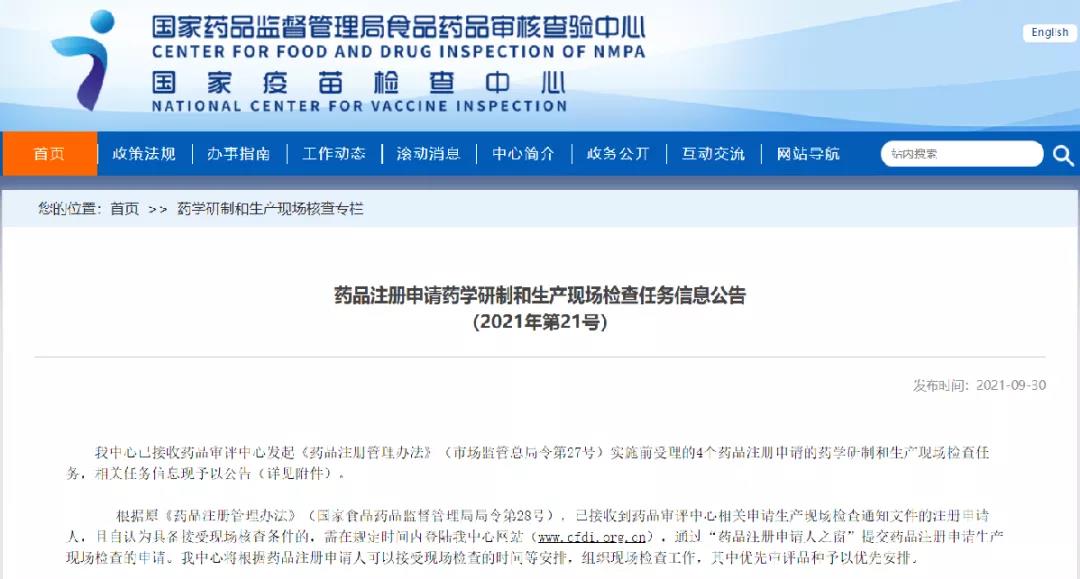
扫描下方二维码
查看详细信息

1.本周发布4个品种的国家药品标准公示。
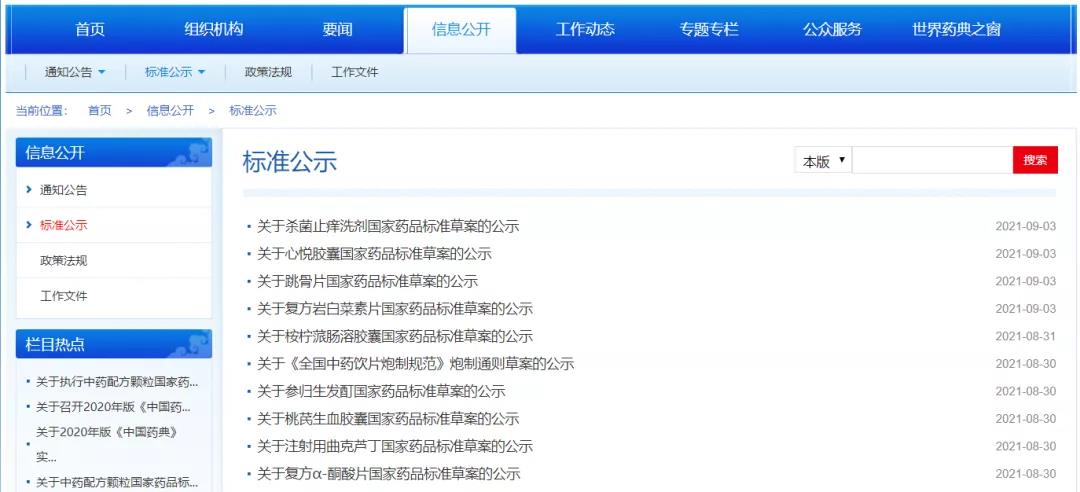
扫描下方二维码
查看详细信息

转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450