政策法规||国家药监局批准注册197个医疗器械产品(附法规概览08.15-08.19)
01
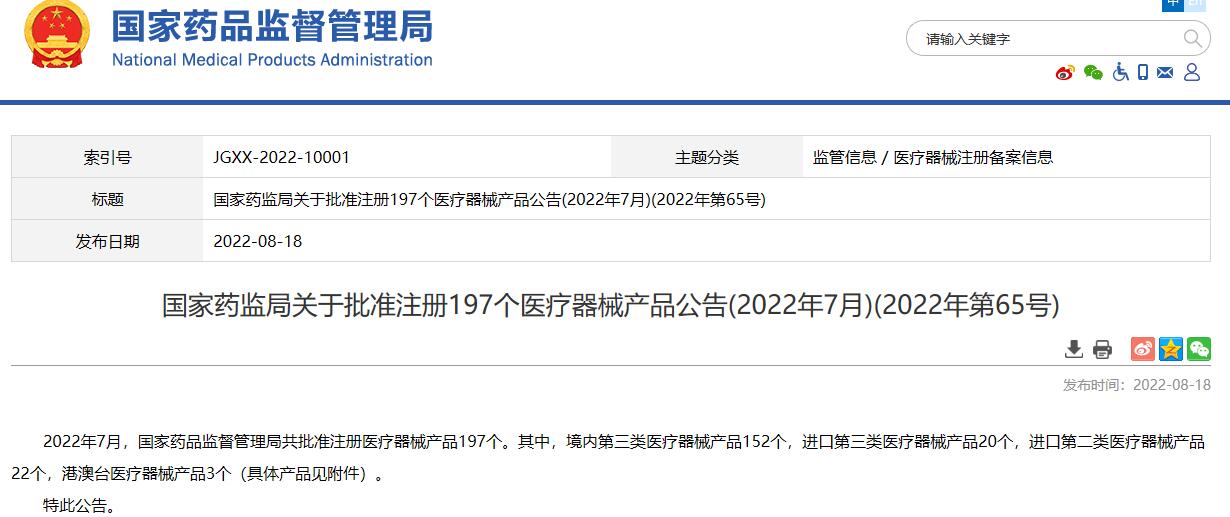
国家药监局关于批准注册197个医疗器械产品公告(2022年7月)(2022年第65号)
长按识别图中二维码
查看详细信息

02
关于公开征求《生理药代动力学模型在儿科人群药物研发中应用的技术指导原则(征求意见稿)》意见的通知
生理药代动力学模型目前在儿科人群药物研发方面应用广泛,为了合理规范使用该模型,药品审评中心组织起草了《生理药代动力学模型在儿科人群药物研发中应用的技术指导原则(征求意见稿)》。

长按识别图中二维码
查看详细信息

03
关于公开征求ICH《M10:生物分析方法验证及样品分析》指导原则实施建议和中文版的通知
为推动ICH三级指导原则在国内的平稳落地实施,我中心拟定了《M10:生物分析方法验证及样品分析》实施建议,同时组织翻译中文版。现对M10实施建议和中文版公开征求意见,为期1个月。

长按识别图中二维码
查看详细信息

04
关于《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》公开征求意见的通知
为促进真实世界证据在药品注册申请中的应用实践,提高研发效率,针对申请人与审评机构开展真实世界证据支持注册申请的沟通交流给出具体要求和指导性建议,我中心组织起草了《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》,现公开征求意见。

长按识别图中二维码
查看详细信息

05
关于公开征求《呼吸道合胞病毒感染药物临床试验技术指导原则》意见的通知
呼吸道合胞病毒是世界范围内引起5岁以下儿童急性下呼吸道感染最常见的病毒病原,是造成婴幼儿病毒性呼吸道感染住院的首要因素。国内多家制药企业已开始呼吸道合胞病毒感染药物的研发。目前国内外尚参考的指导原则,为进一步明确技术标准,提高企业研发效率。

长按识别图中二维码
查看详细信息

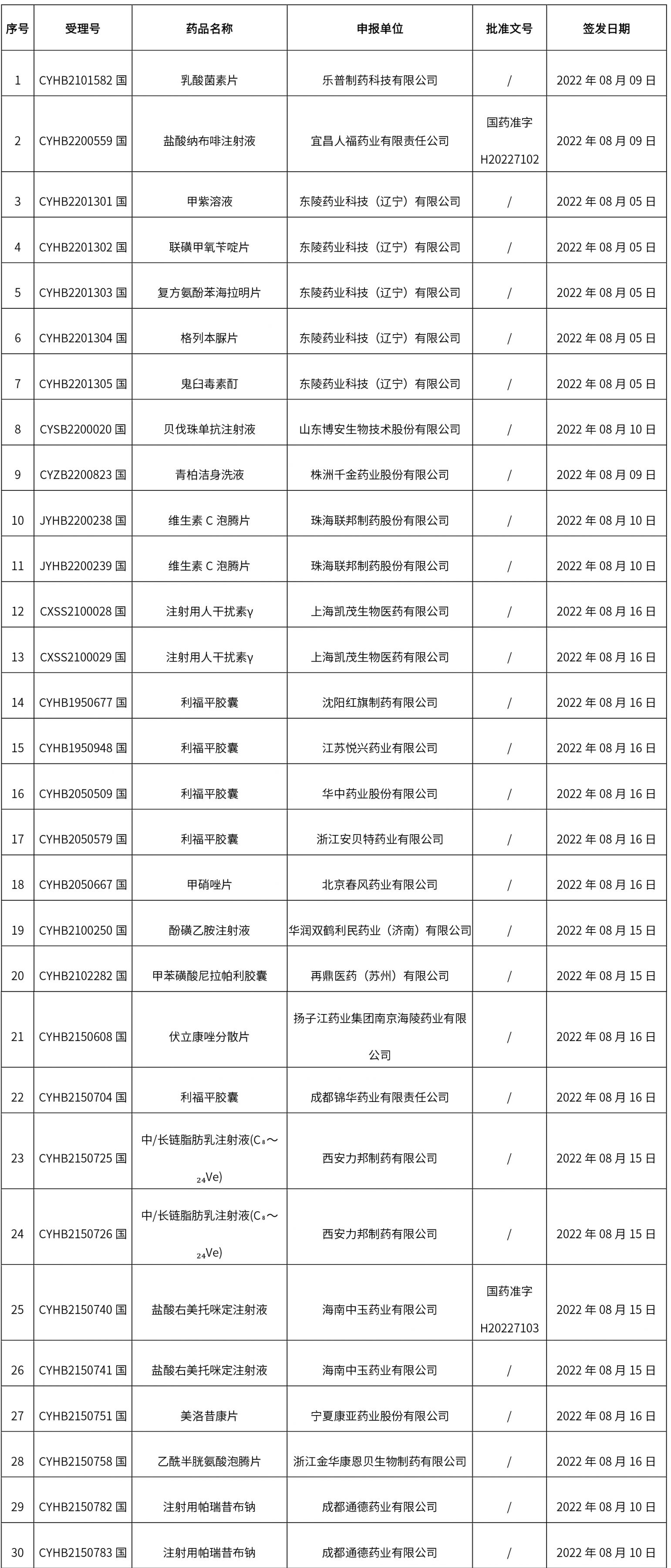
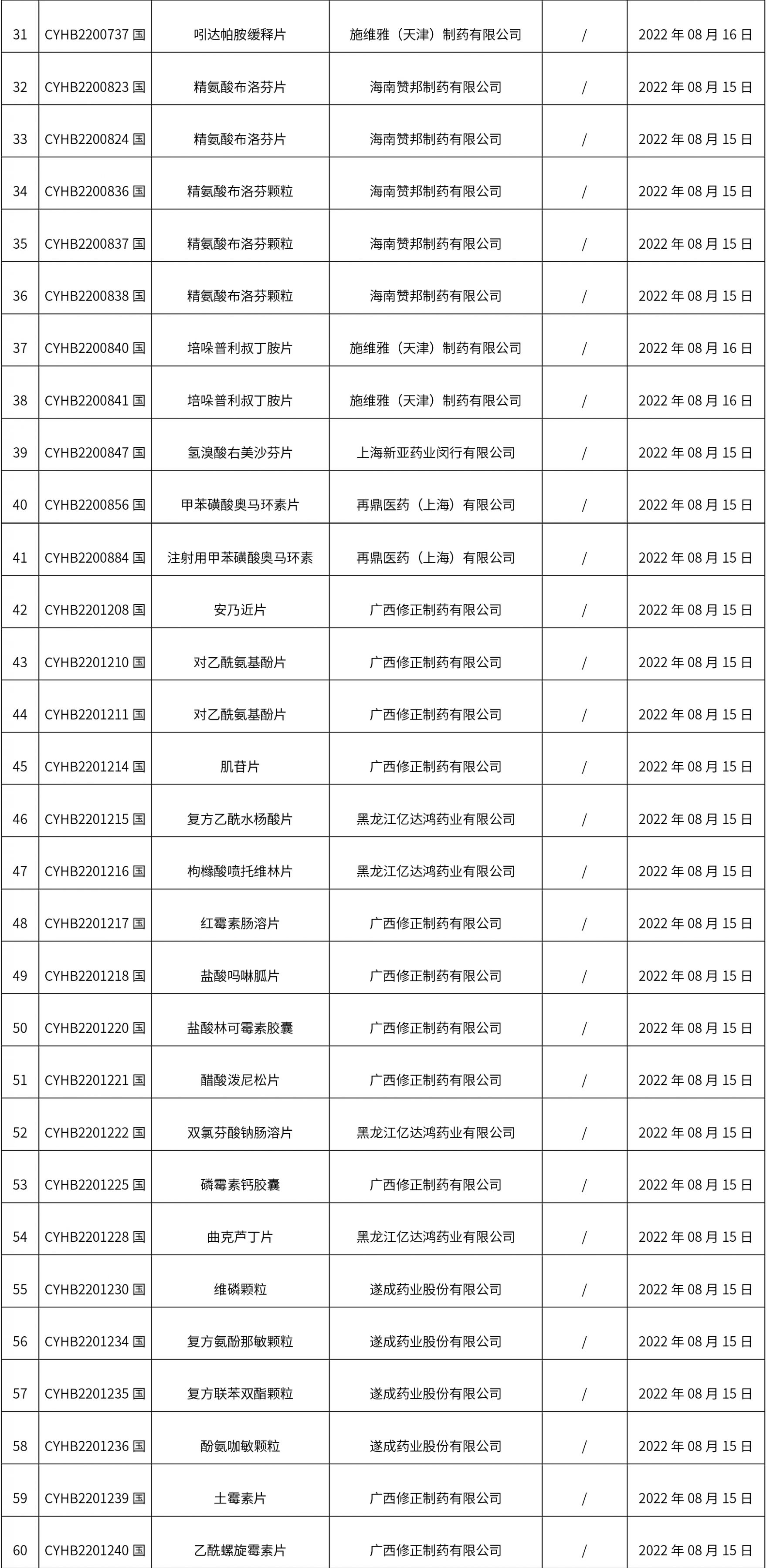
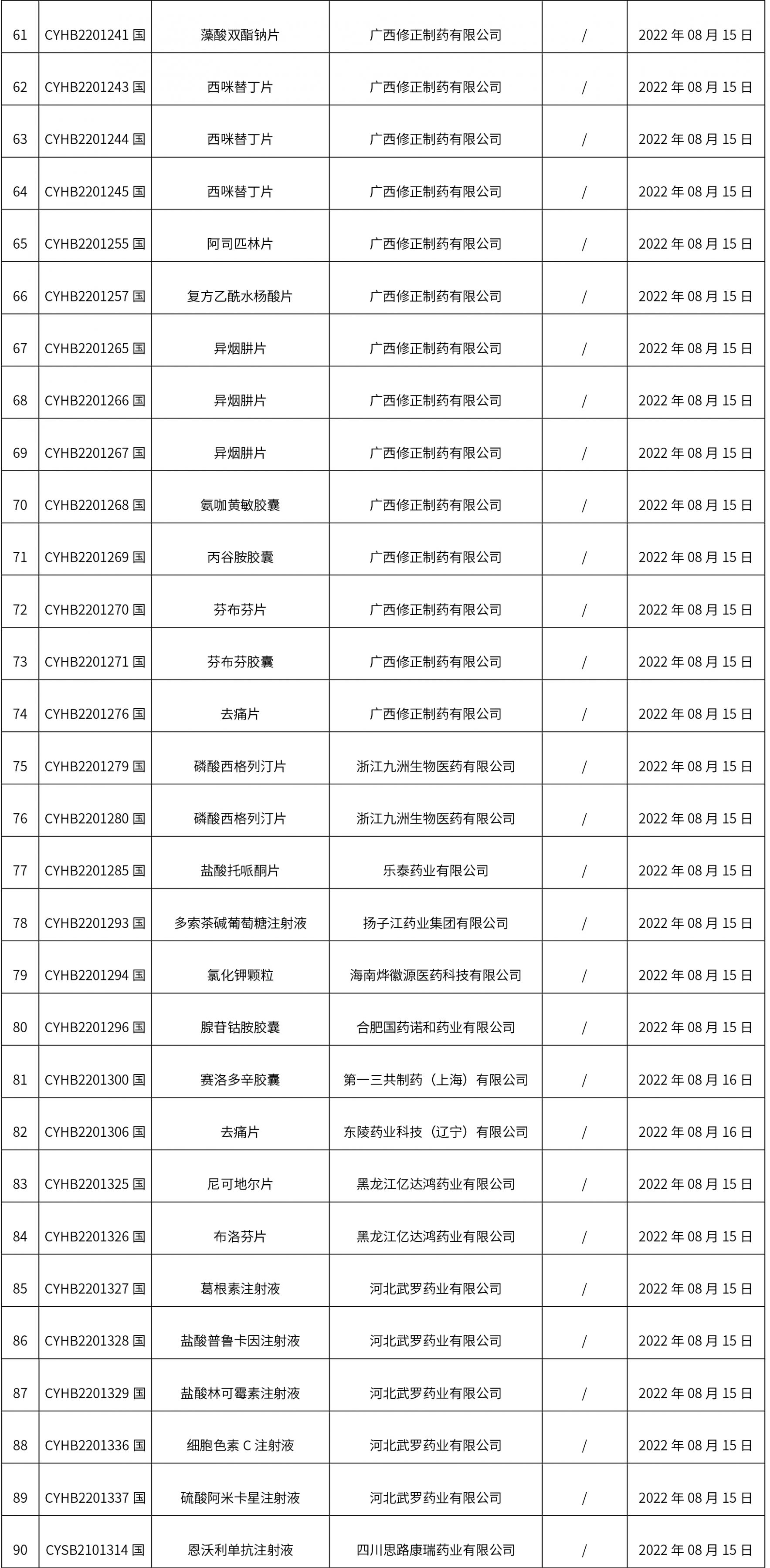
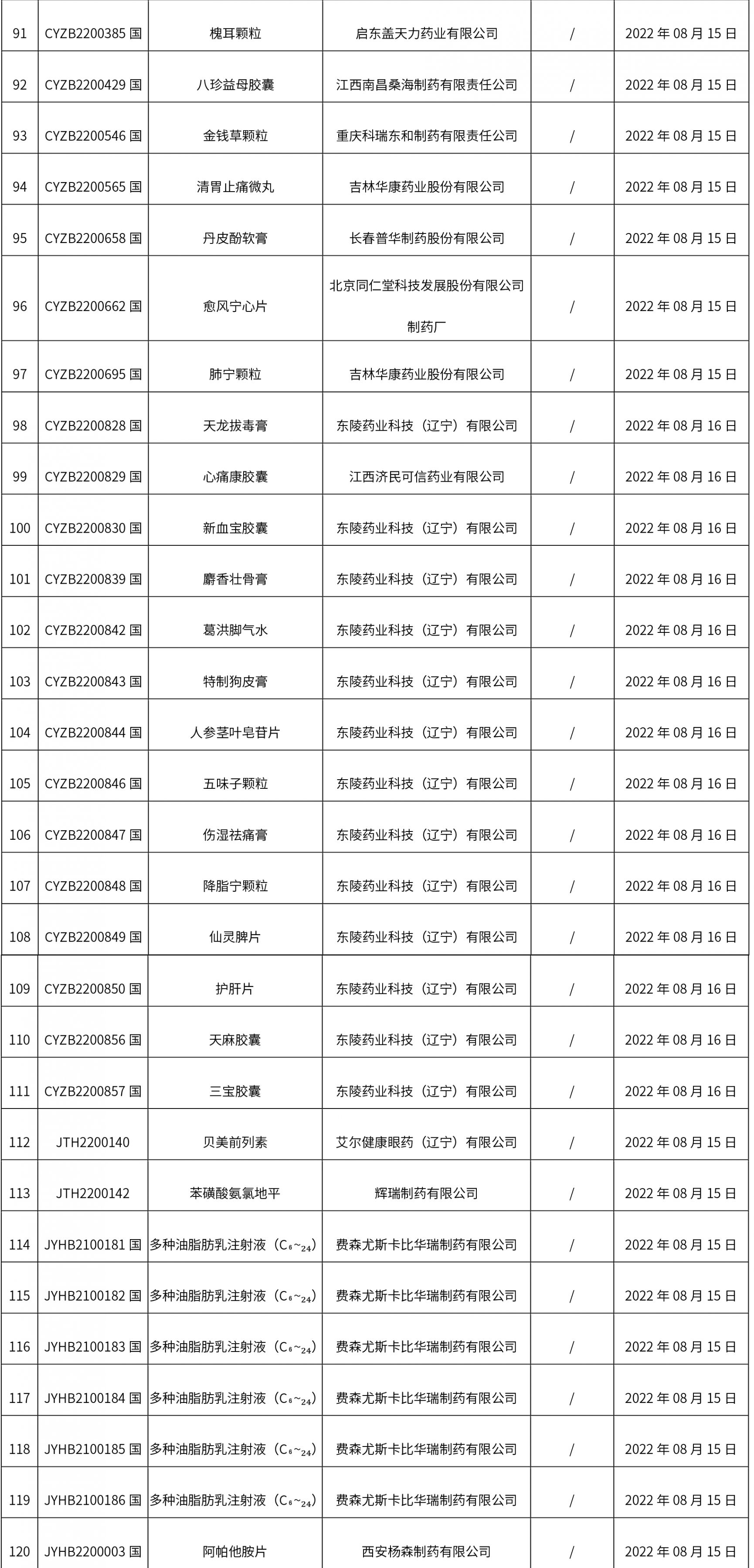
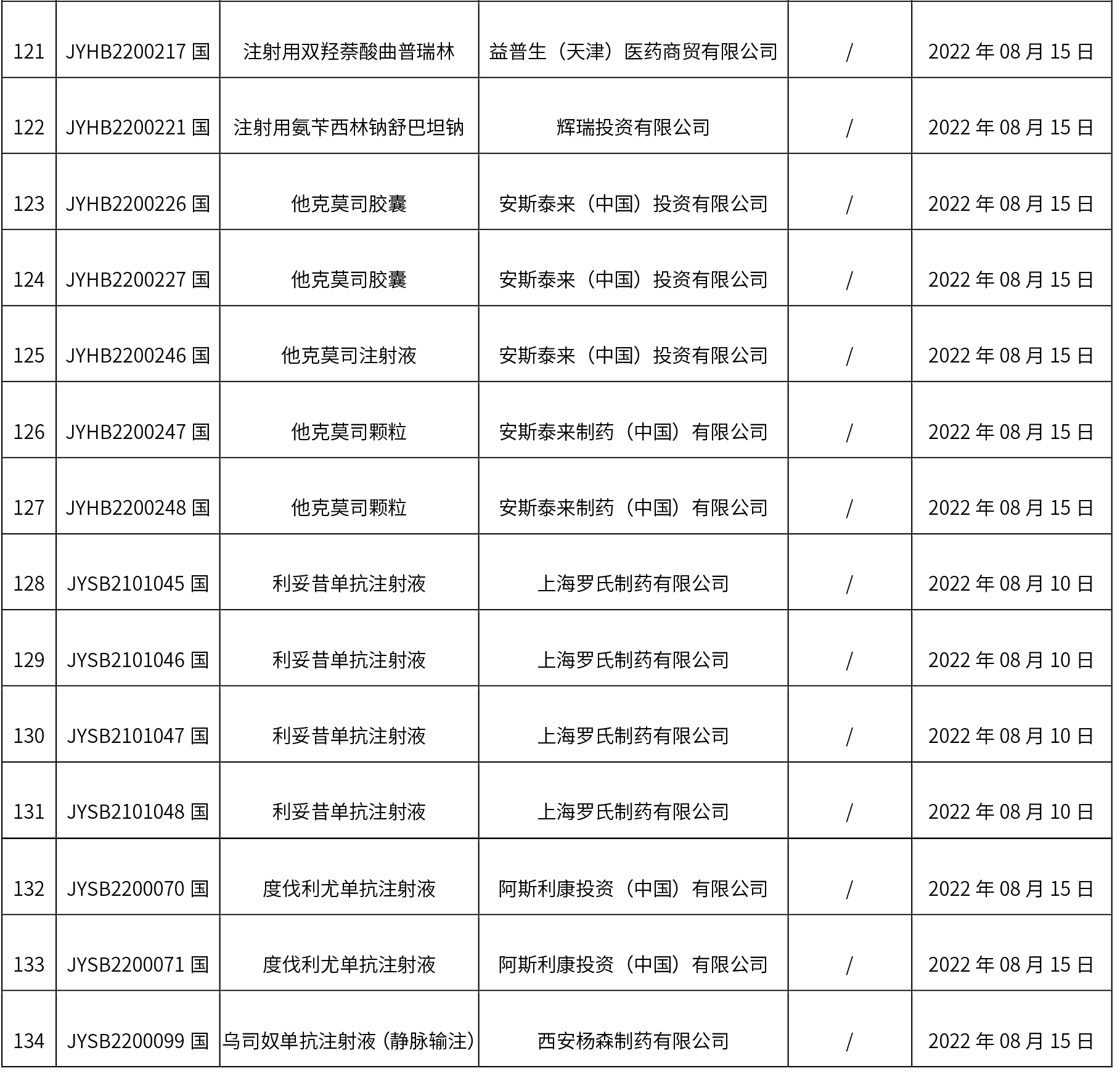
1. 本周(截止到8.19下午2:48)共发布了134个品规的药品批准证明文件待领取信息,其中一致性评价 15个,注射剂 35个。
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450