政策法规||仿制药参比制剂目录(第五十九批)发布(附本周法规概览09.26-09.30)
本周热点
01
国家药监局关于发布仿制药参比制剂目录(第五十九批)的通告(2022年第46号)
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物,参比制剂应为处方工艺合理、质量稳定、疗效确切的药品。
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第五十九批),新增67个品规的参比名单;已发布化学仿制药参比制剂增补目录13个,多为增加持证商,个别品规(噻托溴铵粉吸入剂/噻托溴铵吸入粉雾剂)是“修订规格及药品通用名称”。
扫描识别图中二维码
查看详细信息

02
国家药监局药审中心关于发布《药物临床依赖性研究技术指导原则(试行)》的通告(2022年第35号)
药物临床依赖性研究是具有潜在滥用风险的新药上市前的重要研究内容,我国尚无专门技术要求对此类研究进行规范管理。
在国家药品监督管理局的部署下,药审中心组织制定了《药物临床依赖性研究技术指导原则(试行)》根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,于2022年9月26日发布,自发布之日起施行。

扫描识别图中二维码
查看详细信息

03
关于公开征求《咀嚼片(化学药品)质量属性研究技术指导原则(征求意见稿)》意见的通知
为明确对咀嚼片(化学药品)质量属性研究的技术要求,以更好地指导企业进行研究以及统一监管要求,国家药品监督管理局药品审评中心经调研以及与专家和业界讨论,组织起草了《咀嚼片(化学药品)质量属性研究技术指导原则(征求意见稿)》。

扫描识别图中二维码
查看详细信息

04
关于公开征求《治疗卵巢癌新药临床研发技术指导原则(征求意见稿)》意见的通知
现阶段国内尚无治疗卵巢癌新药临床研发相关技术指导原则,现有的指导原则尚不能涵盖和专门针对卵巢癌的临床试验设计的考虑,为进一步明确技术原则,提高新药研发效率,化药临床一部相关适应症小组组织撰写了《治疗卵巢癌新药临床研发技术指导原则》,形成征求意见稿,供药物研发相关人员参考。

扫描识别图中二维码
查看详细信息

01
关于药审中心与中国药品监督管理研究会合作举办“细胞和基因治疗产品药学研究与评价审评考虑”线上培训的通知

扫描识别图中二维码
查看详细信息

02
关于公开征求《基于人用经验的中药复方制剂新药药学研究技术指导原则(征求意见稿)》意见的通知

扫描识别图中二维码
查看详细信息

03
关于公开征求《中药新药临床试验用药品的制备研究技术指导原则(征求意见稿)》意见的通知

扫描识别图中二维码
查看详细信息

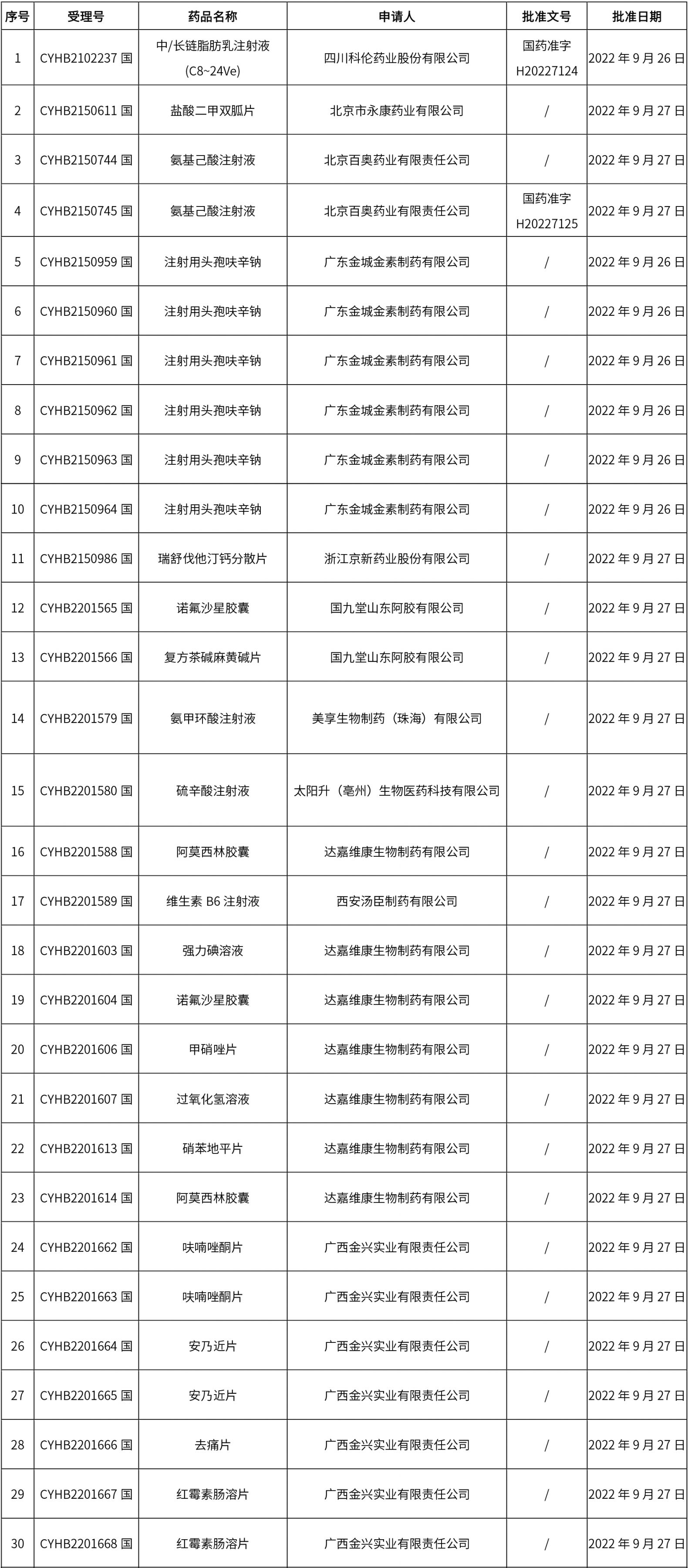
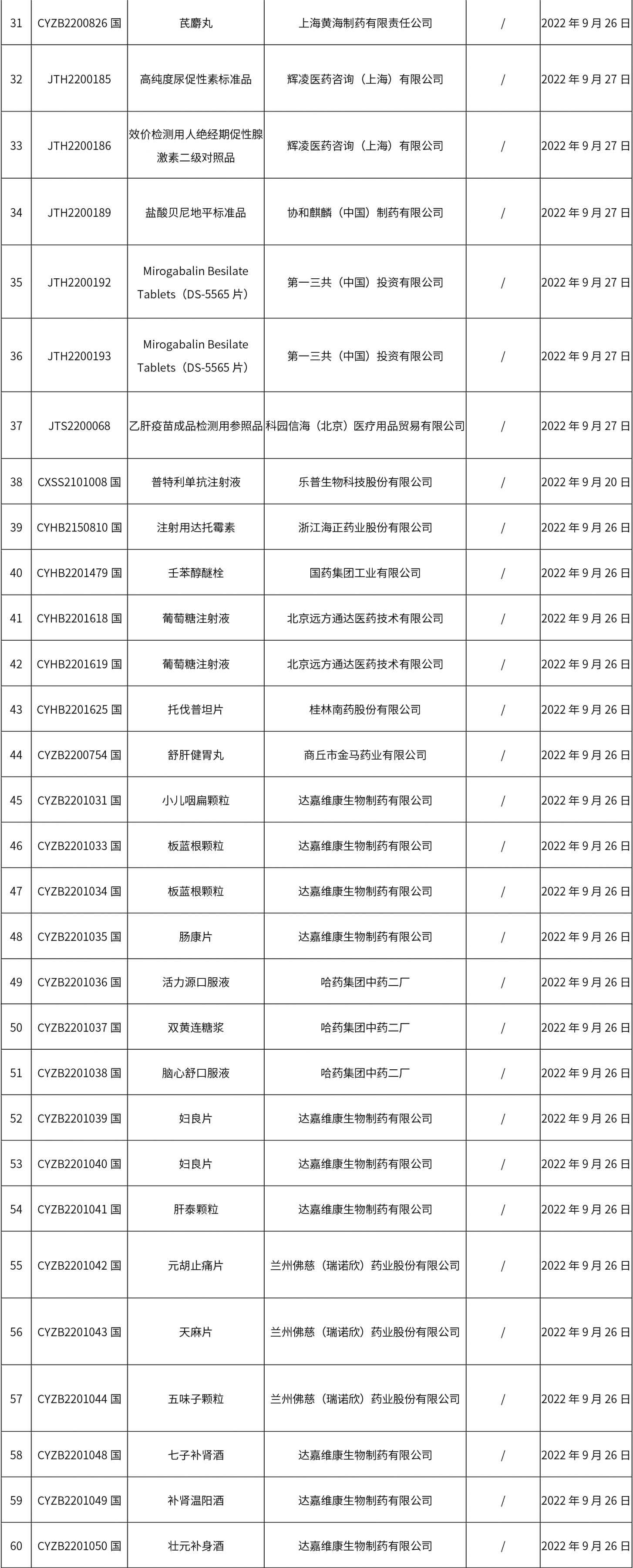
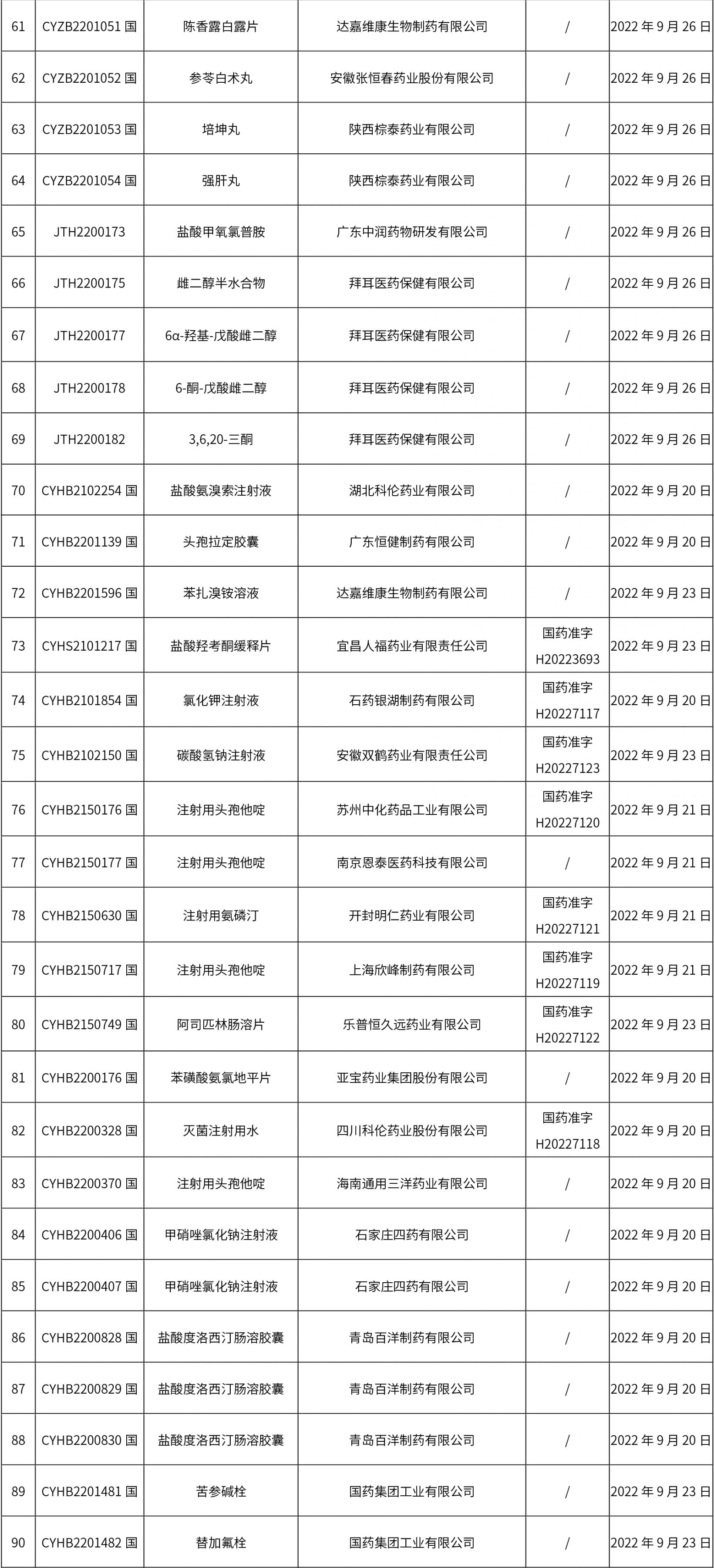
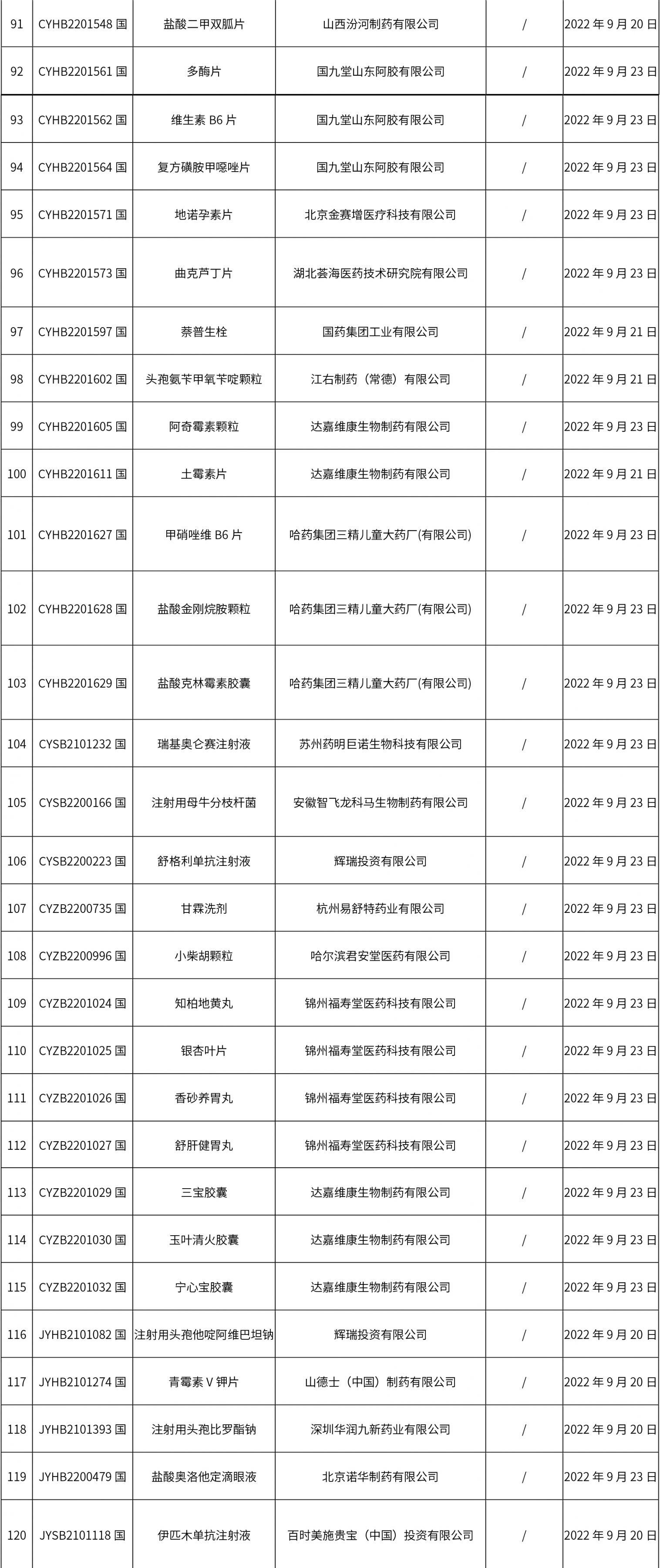
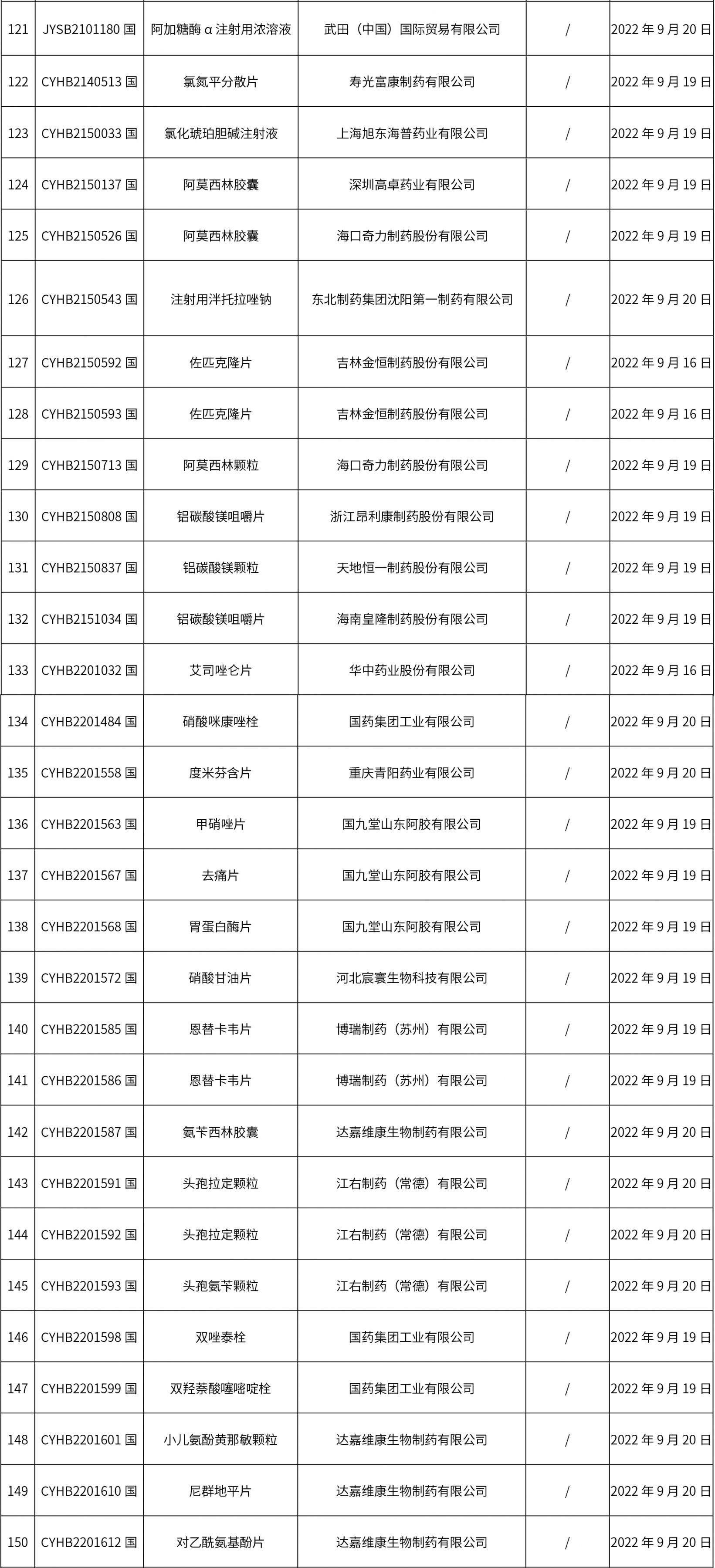
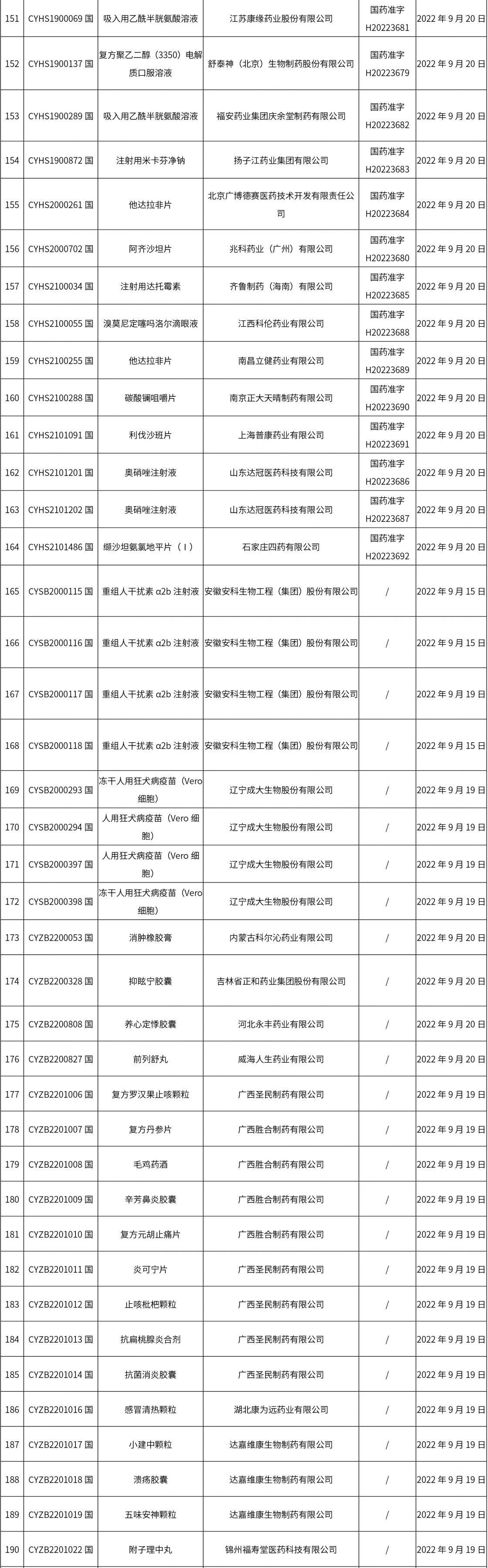
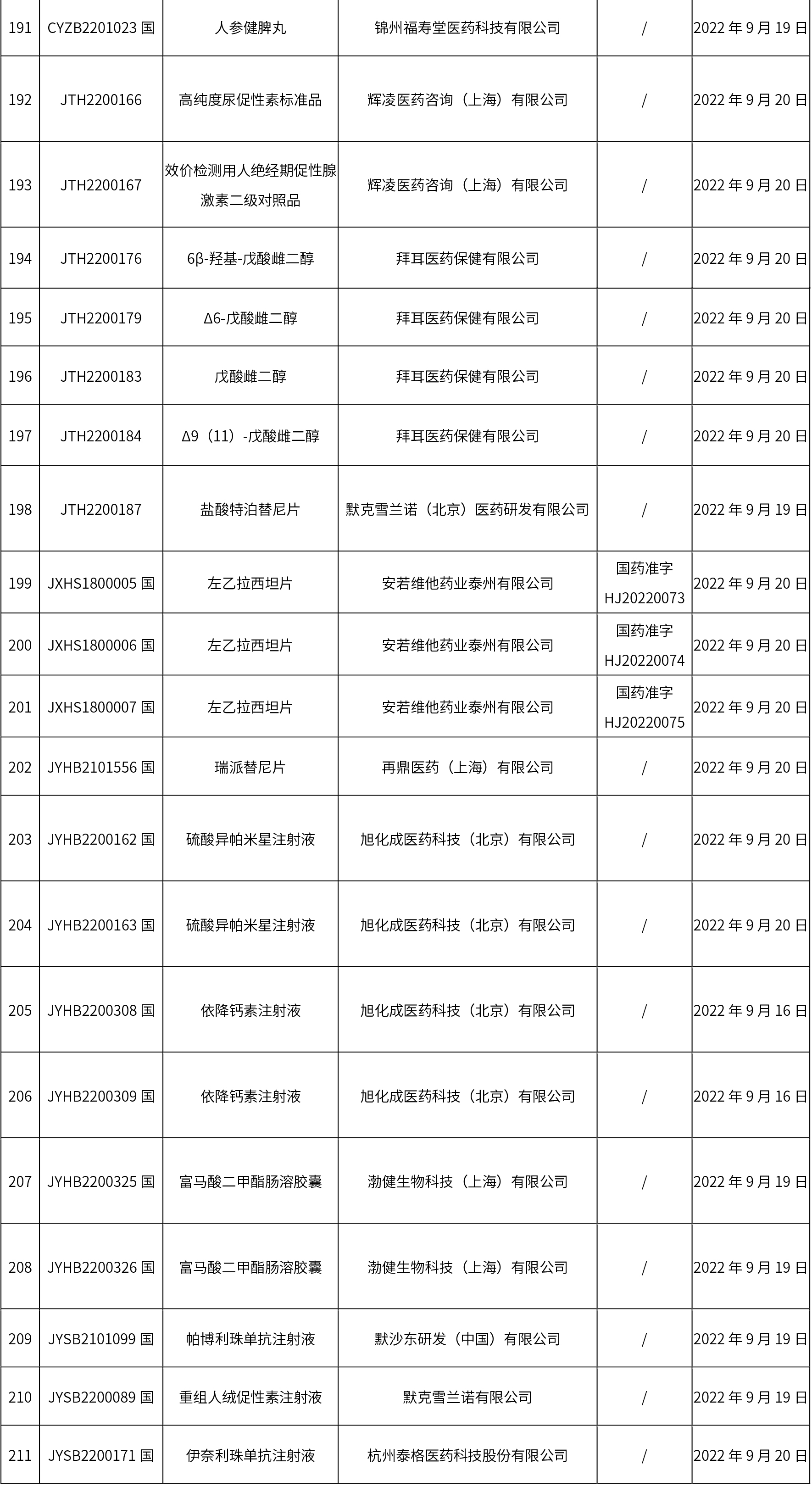
1. 本周(截止09.30中午12:15)共发布了211个品规的药品批准证明文件待领取信息,其中一致性评价27个,注射剂51个(其中1个为灭菌注射用水)。
02
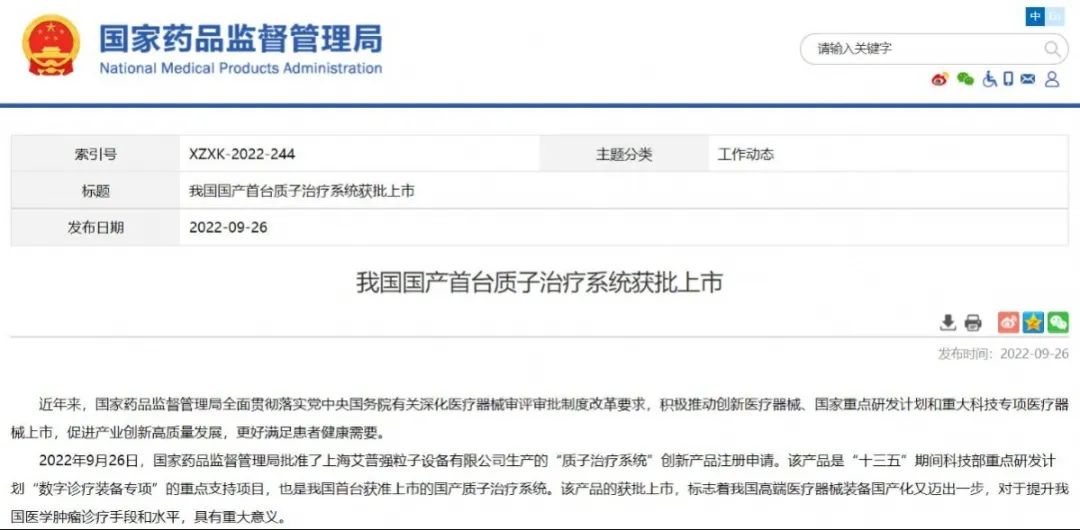
我国国产首台质子治疗系统获批上市
扫描识别图中二维码
查看详细信息

03
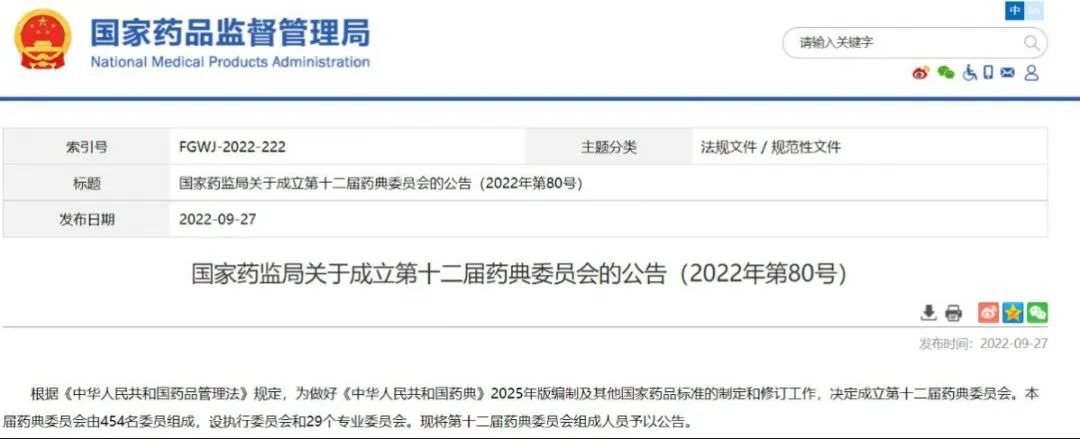
国家药监局关于成立第十二届药典委员会的公告(2022年第80号)
扫描识别图中二维码
查看详细信息

04
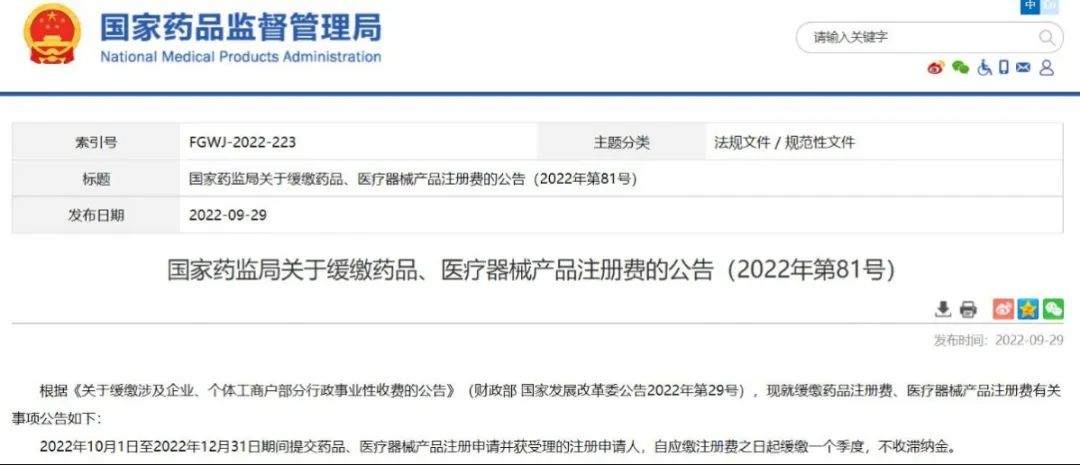
.国家药监局关于缓缴药品、医疗器械产品注册费的公告(2022年第81号)
扫描识别图中二维码
查看详细信息

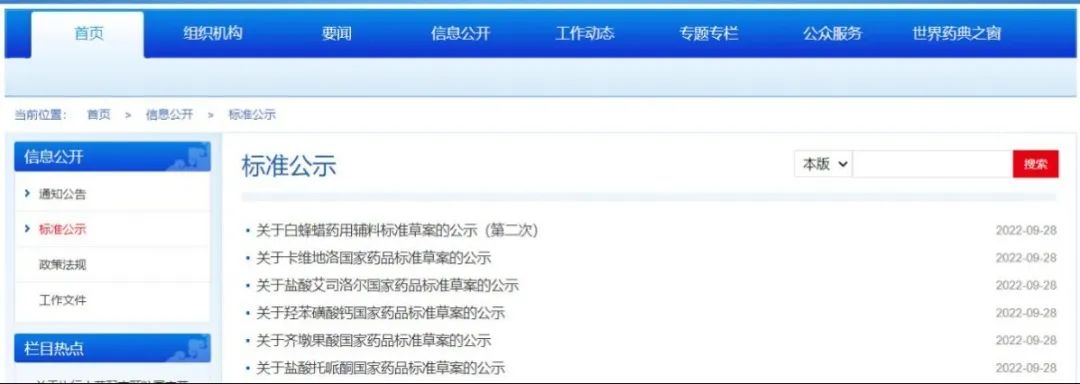
1. 本周药典委发布6个品种国家药品/药用辅料标准草案公示。
扫描识别图中二维码
查看详细信息

-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450