政策法规 || 罕见疾病药物开发中疾病自然史研究指导原则(附法规概览07.24-07.28)
01
国家药监局药审中心关于发布《罕见疾病药物开发中疾病自然史研究指导原则》的通告(2023年第43号)

扫描识别图中二维码
查看详细信息

02
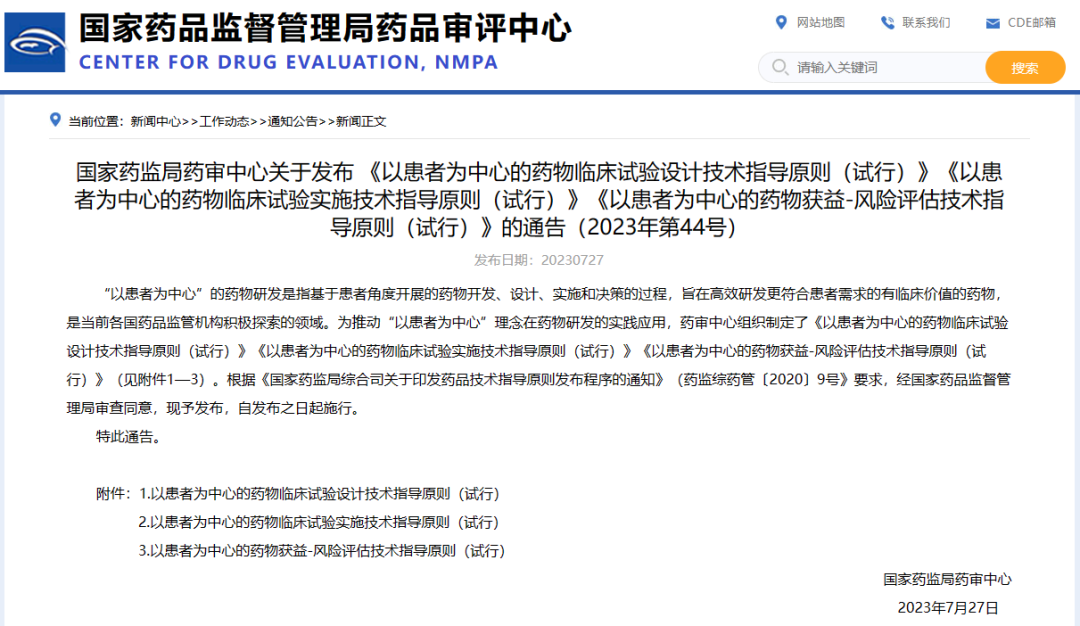
国家药监局药审中心关于发布 《以患者为中心的药物临床试验设计技术指导原则(试行)》《以患者为中心的药物临床试验实施技术指导原则(试行)》《以患者为中心的药物获益-风险评估技术指导原则(试行)》的通告(2023年第44号)
扫描识别图中二维码
查看详细信息

本周法规
CDE
01
关于《乙酰半胱氨酸颗粒生物等效性研究指导原则(征求意见稿)》等五项技术指导原则公开征求意见的通知

扫描识别图中二维码
查看详细信息

02
国家药监局药审中心关于发布《中药新药临床试验用药品的制备研究技术指导原则(试行)》的通告(2023年第41号)

扫描识别图中二维码
查看详细信息

03
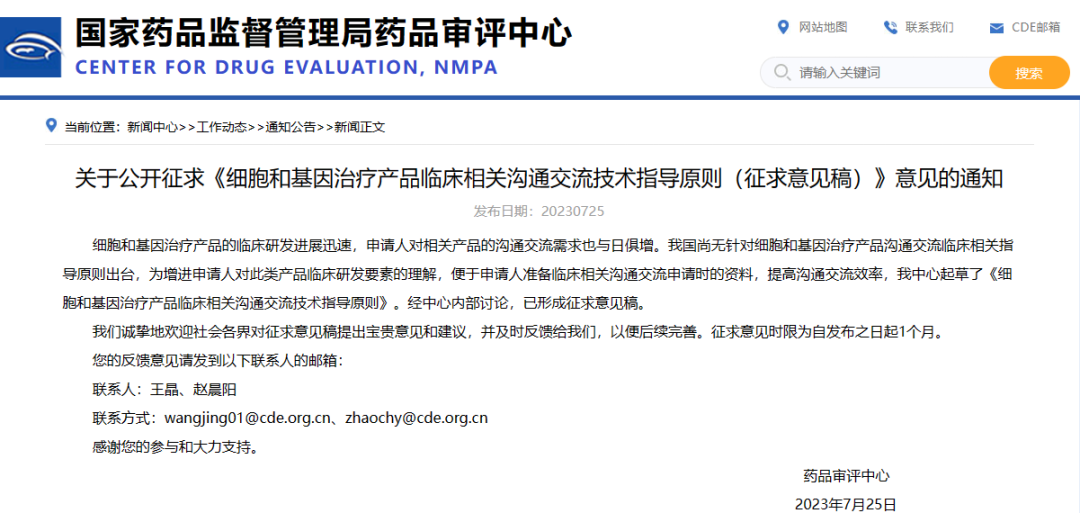
关于公开征求《细胞和基因治疗产品临床相关沟通交流技术指导原则(征求意见稿)》意见的通知
扫描识别图中二维码
查看详细信息

04
国家药监局药审中心关于发布《其他来源于古代经典名方的中药复方制剂药学研究技术指导原则(试行)》的通告(2023年第42号)

扫描识别图中二维码
查看详细信息

05
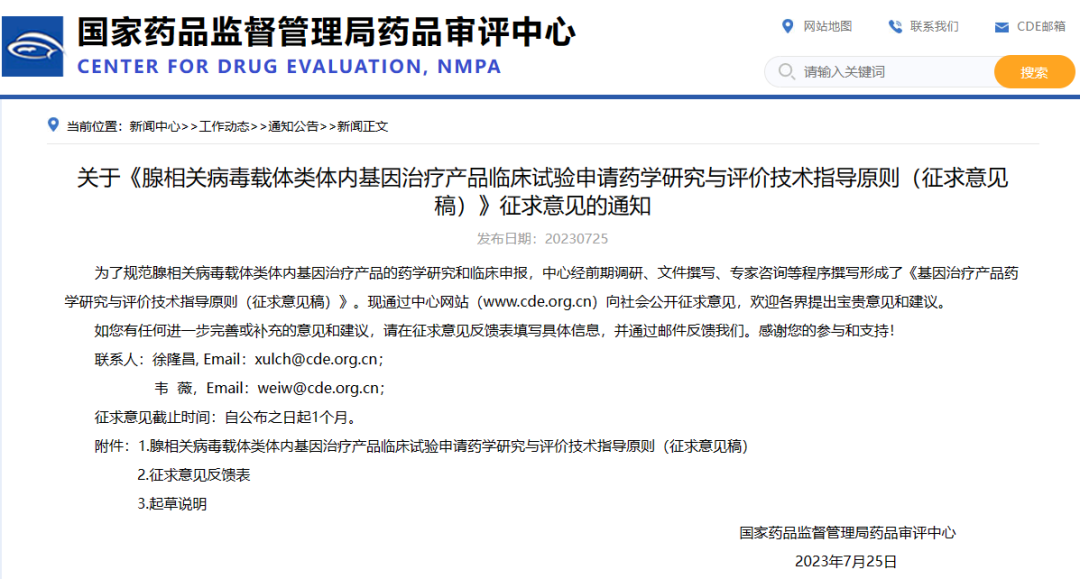
关于《腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则(征求意见稿)》征求意见的通知
扫描识别图中二维码
查看详细信息

06
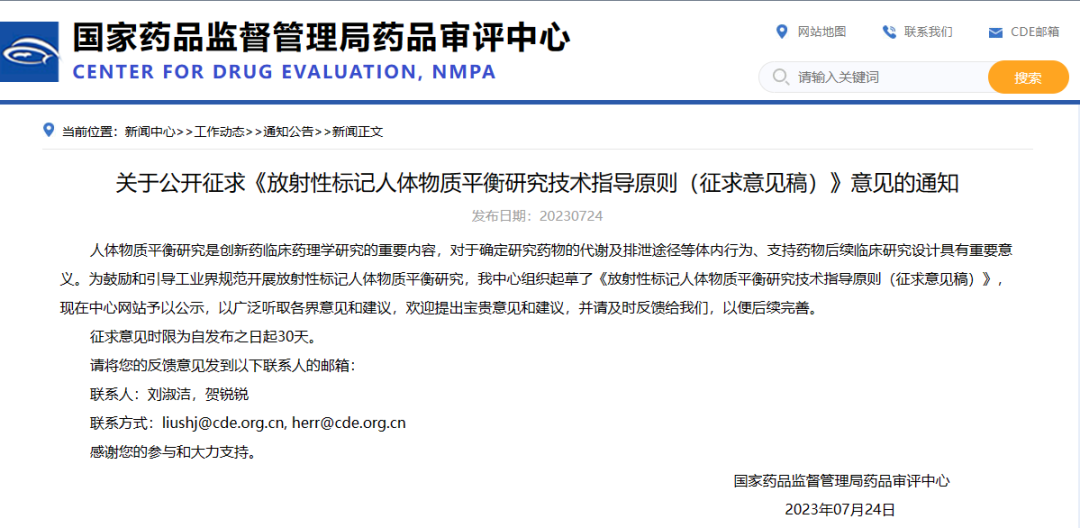
关于公开征求《放射性标记人体物质平衡研究技术指导原则(征求意见稿)》意见的通知
扫描识别图中二维码
查看详细信息

NMPA
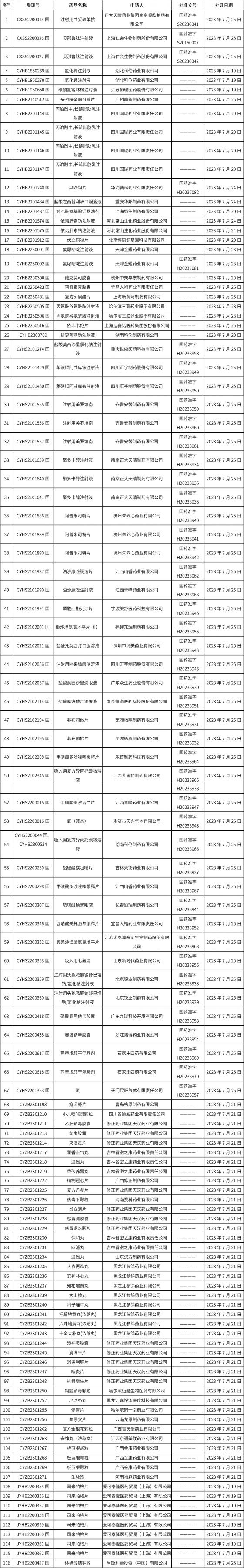
1、截止2023年7月28日 17:00本周发布117个待领取药品批准证明文件,其中注射液25个,11个一致性评价品种。
02
国家药监局关于药物非临床研究质量管理规范认证公告(第6号) (2023年第94号)
扫描识别图中二维码
查看详细信息

03
国家药监局关于发布免于临床评价医疗器械目录的通告(2023年第33号)
扫描识别图中二维码
查看详细信息

04
国家药监局综合司关于同意筹建医疗器械包装标准化技术归口单位的函
扫描识别图中二维码
查看详细信息

-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450