重磅利好!千亿儿童药物市场将迎重大机遇!
目前,国内儿童药物匮乏,儿童药物市场长期处于儿童专用品种少、适宜剂型少、生产企业少、企业关注度高但实际研发热度不高的局面。
由于儿童专用药匮乏,很多患儿在服药时都被当成“缩小版的成人”对待,按照“小儿酌减”的原则把成人药给孩子减量使用,用药靠掰、剂量靠猜!

“这样做存在着巨大的安全隐患,国家药品不良反应监测年度报告(2019年)显示,我国14岁以下儿童患者中不良反应的报告占10.6%。儿童作为特殊用药人群,因脏器发育尚未完全等因素的影响,对药物更为敏感,耐受性较差,因此,儿童要用“儿童药”!
为此,国家药品监督管理局、卫健委、医保局等多部委陆续出台多项鼓励研发儿童药物的利好政策以推动儿童药物的发展,2019版和2020版医保目录调整方案中,将儿童药物列为优先考虑调入药品,进一步激发企业的研发热情。
目前已有多家企业加大对儿童药物的研发投入,随着与国家鼓励政策相关的配套措施落地、资源的跟进,千亿儿童用药将迎来前所未有的发展机遇。
我国儿童人口基数庞大,根据2020年国家统计局数据显示,2019年我国儿童人口数为2.35亿人,占全国总人口的16.8%。且随着“二胎政策”的放开,儿童人口数量将呈现明显的上升趋势,儿童药物市场需求也将随人口数量的增加而明显扩张。
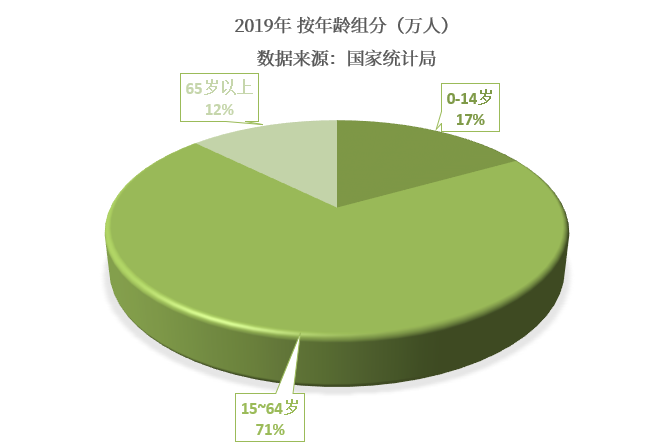
(我国儿童的概念通常是指0~14岁的人群)
02 儿科用药市场规模高
2013年~2018年全球儿童药物市场规模呈逐年上升趋势,近5年复合增长率(CAGR)为3.76%,2018年全球儿童药物市场规模约为973亿美元。
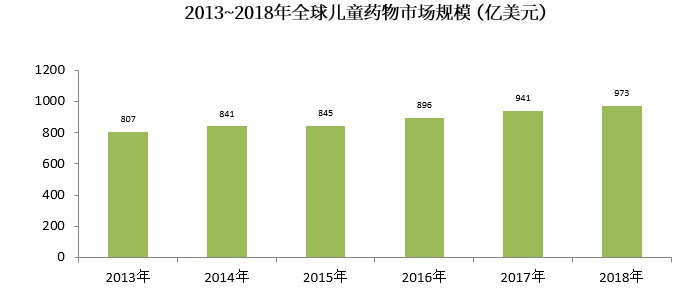
(数据来源:前瞻产业研究院公开资料)
国内市场儿童药物规模与国际市场相匹配,2012年~2018年CAGR为+9.83%,2018年我国儿科用药市场规模约为786.07亿元,较上年同比增长11.72%,国内儿科用药市场规模增长迅速。
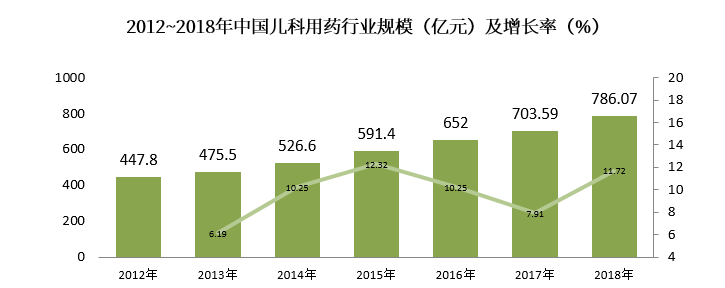
(数据来源:前瞻产业研究院公开资料)
全国工商联药业商会的调查显示,国内6000多家药厂中,专门生产儿童药品的仅10余家,有儿童药品生产部门的企业也仅30多家,总体企业间竞争压力较小。目前国内重点从事儿童药企业主要为葵花药业、葫芦娃药业、康芝药业、哈药集团、亚宝药业、江中药业、华润双鹤、山大华特、济川药业、羚锐制药、长春高新、健民集团、汉森制药、臣功制药等。
Insight数据库统计显示,截止2021年1月1日,共收录上市批准产品(化药、中药和生物制剂等)批准文号数为228448个(按成分浏览为8487个),其中儿科专用药物(儿童、儿科、小儿等统计)批准文号总数为3826个(成分241个);在化药领域,总批准文号为151473(成分2195个),儿童专用药物的总批准文号为1598(成分55个)。目前国内儿科专用产品的批准文号数量以及活性成分数量均较少,相对于全国2.2亿儿童,远远不够,当前我国儿童药品短缺问题非常严峻,亟待补齐。

欧美国家为儿科用药政策先行者,政策出台鼓励儿科用药研发,在美国,通过两大互补立法即《儿科研究平等法》(PREA)和《最佳儿童药品法》(BPCA)对儿童新药的开发、儿童临床试验的管理、儿童药品的信息、儿童药品的临床使用等从保护儿童权益的角度进行了规定,强制性要求制药企业对每一种可能发展为儿童用药的新药必须提供该药的儿科研究数据。同时也对制药企业进行儿童新药开发提供了包括资金、税收、快速评审、市场垄断权和研究资助等诸多方面的优惠措施。
在我国,为鼓励国内药企加大儿童药的研发和生产,近年来,政府部门陆续出台了一系列相关政策,包括鼓励研发、优先评审、加强医院配备、招标采购直接挂网等。
此外,国家审评中心陆续发布多项儿科药物研发指导原则,以进一步规范、指导儿童药物研发中涉及的药学、临床、审评等相关工作,促进企业研发顺利开展。
《关于保证儿童用药的若干意见》印发,对保障儿童用药提出了具体要求。
《关于成立国家卫生计生委儿童用药专家委员会的通知》印发,完善儿童用药数据,促进儿童用药安全科学合理使用,保障儿童基本用药需求,建立科学规范的儿童用药指南。
关于征求《关于鼓励药品医疗器械创新保护创新者权益的相关政策(征求意见稿)》意见的公告,对批准上市既属于创新药又属于罕见病用药、儿童专用药,给予10年数据保护期。
《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》印发,对创新药、儿童专用药、及挑战专利成功药品等给予一定的数据保护期。
李克强总理8月30日主持召开国务院常务会议决定,要求基本药物目录调整重点聚焦癌症、儿科、慢性病等病种。
公布《2019年国家医保药品目录调整工作方案》的公告,优先考虑国家基本药物、癌症及罕见病等重大疾病治疗用药、慢性病用药、儿童用药、急救抢救用药等。
第十三届全国人民代表大会常务委员会第十二次会议第二次修订)《中华人民共和国药品管理法》:国家采取有效措施,鼓励儿童用药品的研制和创新,支持开发符合儿童生理特征的儿童用药品新品种、剂型和规格,对儿童用药品予以优先审评审批。
《药品注册管理办法》公布,将符合儿童生理特征的儿童用药品新品种、剂型和规格的产品纳入优先审评审批程序中。
《2020年国家医保药品目录调整工作方案》公布,将临床急需境外新药名单、鼓励仿制药品目录或鼓励研发申报儿童药品清单、且于2020年8月17日前经国家药监部门批准上市的药品纳入2020年药品目录拟新增药品范围。
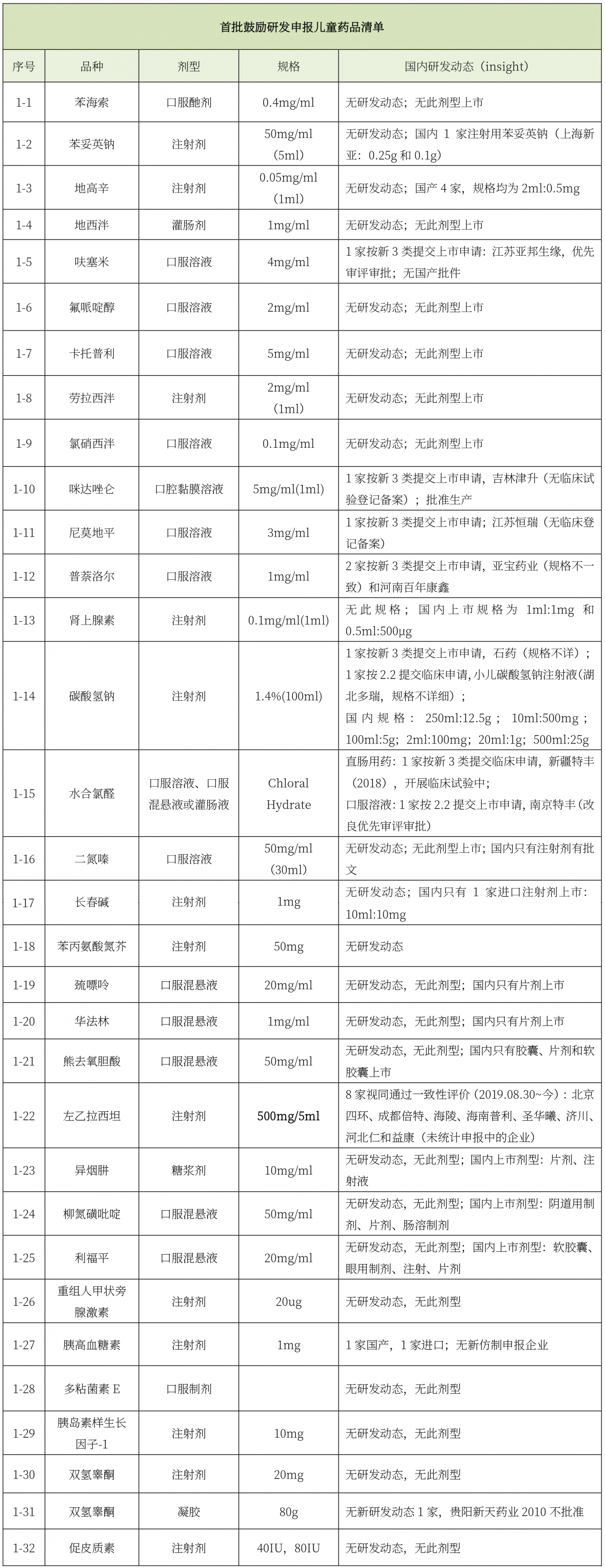
《首批鼓励研发申报儿童药品清单》印发。
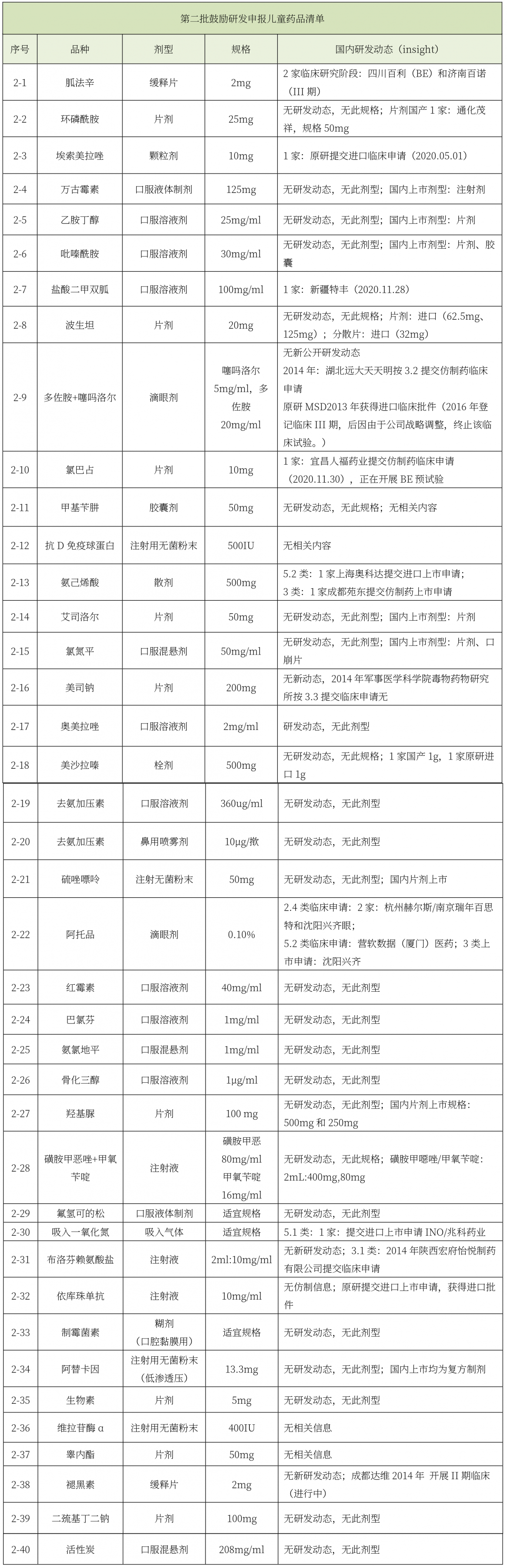
《第二批鼓励研发申报儿童药品清单》印发。
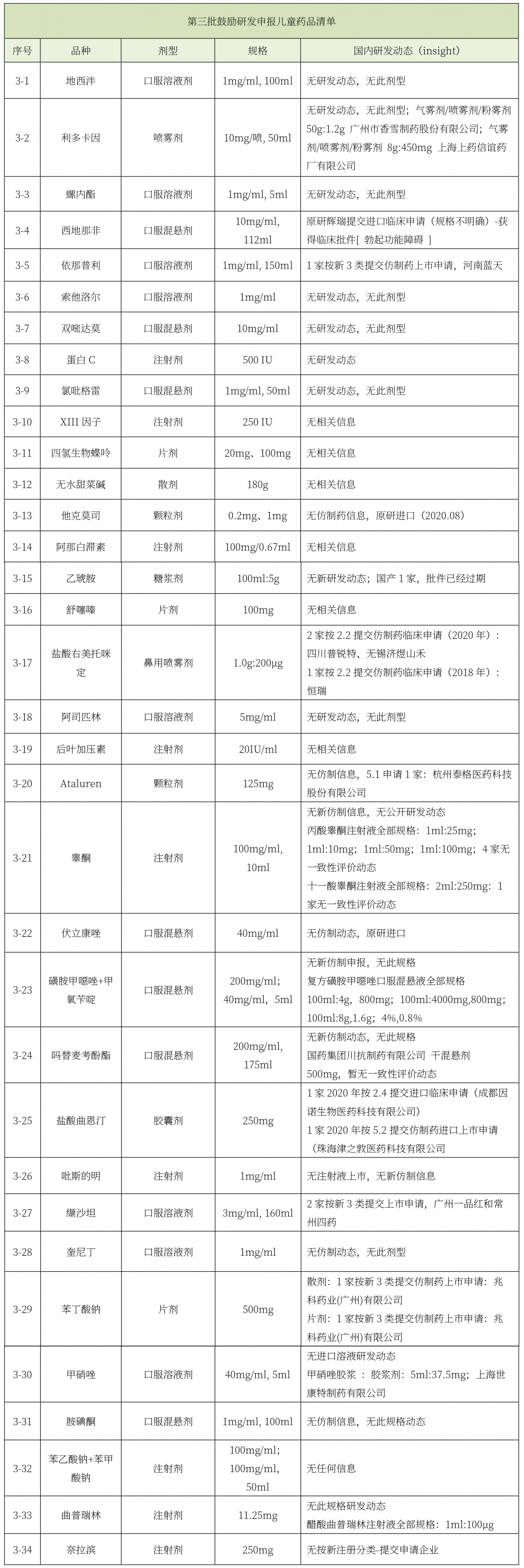
《第三批鼓励研发申报儿童药品清单》印发。
《儿科人群药代动力学研究技术指导原则》发布,重点阐明儿科人群研究的特殊性,为计划在儿科人群中开展药代动力学研究的注册申请人和科研机构提供指导性建议,鼓励和推动针对我国儿科人群的药物研发。
《儿科人群药物临床试验技术指导原则》制定,提出了从成人数据向儿科人群数据外推的原则和要求,进一步规范和指导我国儿科人群药物临床试验。
《成人用药数据外推至儿科人群的技术指导原则》制定,进一步鼓励研制儿科用药,最大程度利用已有数据,减少不必要的儿科研究,通过数据外推完善和丰富说明书中儿科人群用药信息,指导临床用药。
《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》的通告发布:(一)批准用于我国儿童的新活性成分药品上市后临床安全有效性研究;(二)境外已批准用于成人和儿童、我国人的药品,采用数据外推策略申报。
《儿童用药(化学药品)药学开发指导原则(试行)》发布,重点从给药途径和剂型的选择、原料药、辅料、包装系统和给药装置、患者可接受性等方面阐述儿童用药药学开发的特点,旨在为儿童用药的药学开发提供研发思路和技术指导。
《儿科用药临床药理学研究技术指导原则》发布,从儿科用药临床药理学研究内容、特点、主要应用和研究方案设计要点等方面,对业界关注的数据外推和无法外推的情况进行了说明;通过数据外推,可减少或豁免部分儿科临床试验,优化儿科人群临床试验。
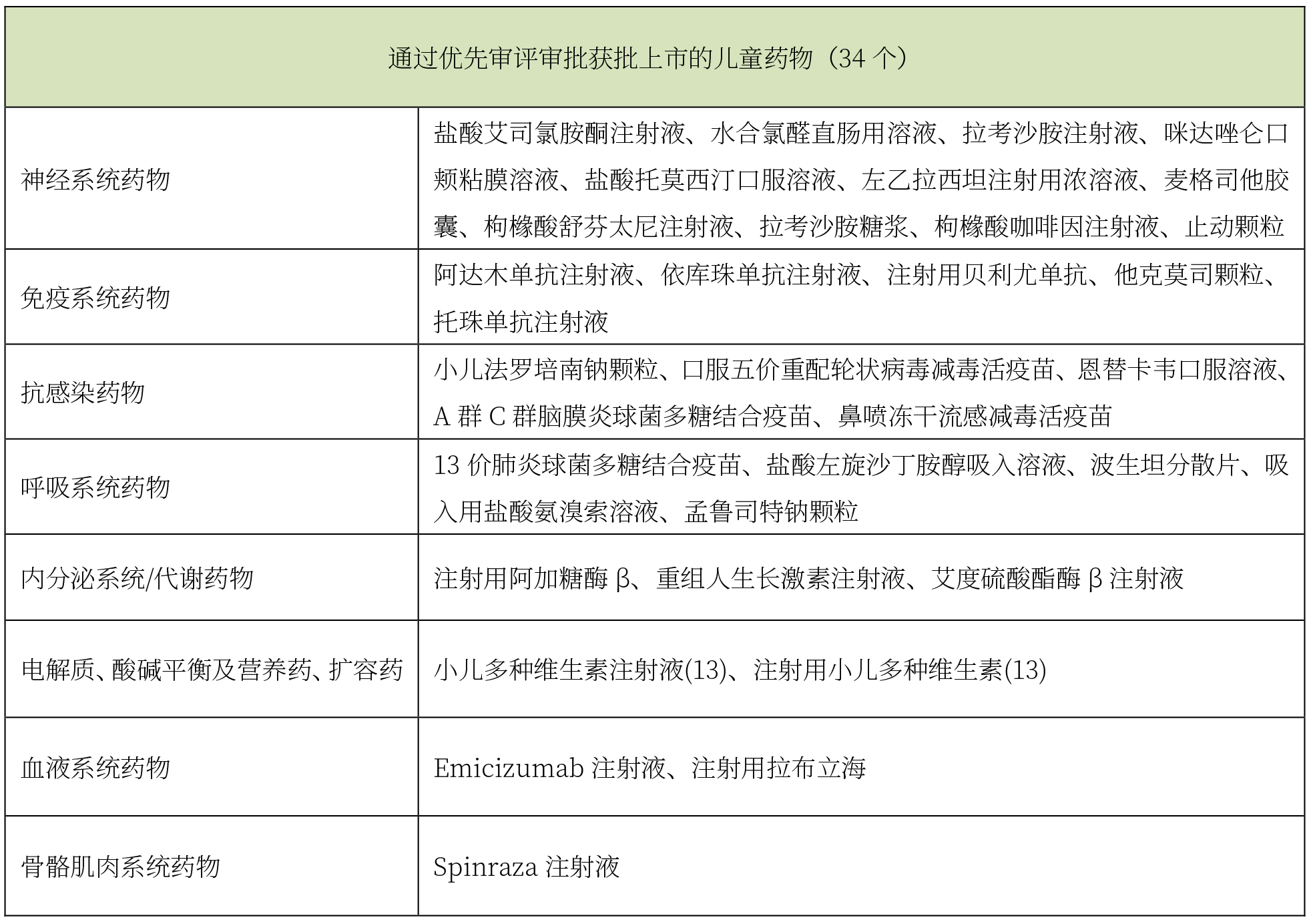
在儿童药物优先审评审批方面,2016-2019年国家局已陆续将989个品种纳入优先审评程序中,其中儿童药物96件(占比为9.7%),已有80多个企业享受优惠政策。截至目前,通过儿童用药优先审评审批上市的产品共计34个,详见下表。
据Insight统计,在卫健委、工信部和国家药监局联合发布的106种鼓励研发申报儿童药品中,其中有83个品规暂无公开研发动态或相关研发信息,对于拟布局儿童药物市场的企业,还有很多的选择空间。
首批鼓励研发申报儿童药品清单(总计32个品种)中,有7个品种企业研发热度较高,依次为左乙拉西坦注射液、普萘洛尔口服溶液、碳酸氢钠注射剂、其他呋塞米口服溶液、咪达唑仑口腔黏膜溶液、尼莫地平口服溶液、水合氯醛灌肠液,水合氯醛口服溶液。
截止目前参与清单中项目研发的仿制药企业共15家,分别为江苏亚邦生缘、吉林津升、江苏恒瑞、亚宝、石药、湖北多瑞、新疆特丰、南京特丰、北京四环、成都倍特、海陵、海南普利、圣华曦、济川、河北仁和益康等。
第二批鼓励研发申报儿童药品清单(总计40个品种)中,有7个品种在国内有公开研发动态,研发热度依次为阿托品滴眼剂(3家)、胍法辛缓释片(2家)、氨己烯酸散剂(2家)、埃索美拉唑颗粒剂(1家)、盐酸二甲双胍口服溶液剂(1家)、氯巴占片(1家)、吸入一氧化氮(1家)。在第二批清单中,国内企业参与热度不高,截止目前仅有5家企业参与,分别为四川百利、济南百诺、新疆特丰、宜昌人福、成都宛东。
第三批鼓励研发申报儿童药品清单(总计34个品种)中,有6个品种有公开研发动态,研发热度依次为盐酸右美托咪定鼻用喷雾剂(3家)、盐酸曲恩汀胶囊剂(2家)、缬沙坦口服溶液剂(2家)、西地那非口服混悬剂(1家)、依那普利口服溶液剂(1家)、苯丁酸钠片剂(1家)、苯丁酸钠散剂(1家)。参与研发的国内企业(9家)主要为河南蓝天、四川普锐特、无锡济煜山禾、恒瑞、成都因诺、广州一品红、常州四药、珠海津之敦、兆科药业。
1、以临床需求为导向,开发申报鼓励研发药物、临床急需药物、短缺药物:2016-2019年期间卫健委、工信部和食药监局推出3批鼓励研发申报儿童药品清单共计108种,这些清单大部分为国外已上市,但国内缺乏的儿童适宜剂型和规格,该清单的发布为我国儿科用药发展指明了方向。
2、规范说明书用药:对于国内儿童,由于儿科用药匮乏,临床上存在超说明书用药情形,包括超使用人群、适应症、用法用量,对于临床常用的超说用书用药产品,可参照广东省药学会初版的历年超药品说明书用药目录、公开文献、资料等筛选,结合企业产品线、科室渠道布局选择相匹配的产品通过补充申请或者2.4类新药申请方式增加使用人群、适应症,规范临床用药,明确说明书标签用药。
3、布局仿制研发儿童适宜剂型,形成儿童特色品牌:颗粒剂、散剂、口服溶液、口服混悬液、口服滴剂、口服乳剂、细粒剂、口崩片、口溶膜剂、干混悬剂、咀嚼片、微片、片剂、分散片、胶囊、注射剂等。
欧盟针对不同年龄段儿童进行了剂型(口服给药途径)推荐:
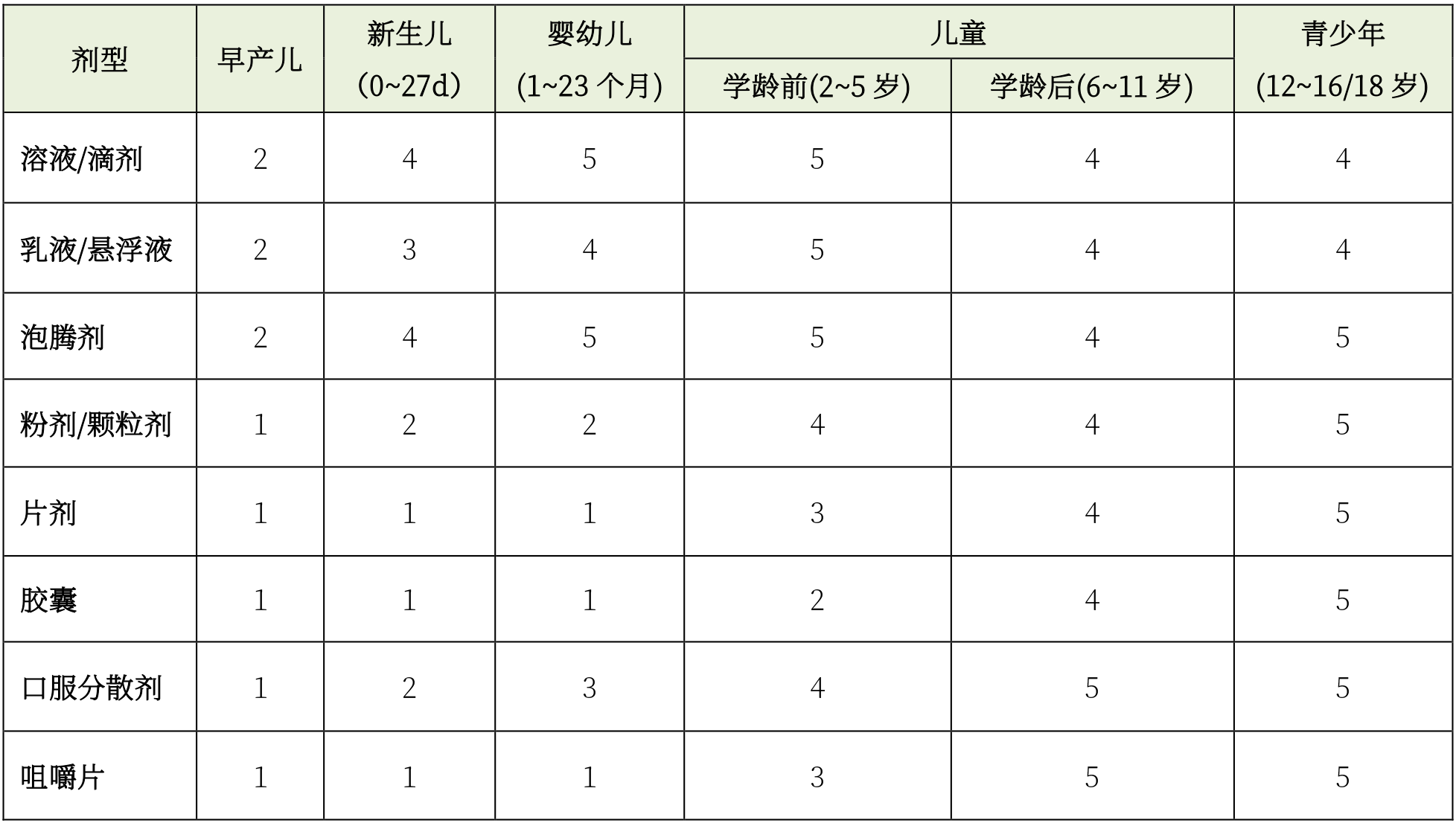
(指标1~5表示儿童对特定剂型的接受程度,数值越高,接受程度越高)
4、规范说明书用药:对于国内儿童,由于儿科用药匮乏,临床上存在超说明书用药情形,包括超使用人群、适应症、用法用量,对于临床常用的超说用书用药产品,可参照广东省药学会初版的历年超药品说明书用药目录、公开文献、资料等筛选,结合企业产品线、科室渠道布局选择相匹配的产品通过补充申请或者2.4类新药申请方式增加使用人群、适应症,规范临床用药,明确说明书标签用药。
5、布局仿制研发儿童适宜剂型,形成儿童特色品牌:颗粒剂、散剂、口服溶液、口服混悬液、口服滴剂、口服乳剂、细粒剂、口崩片、口溶膜剂、干混悬剂、咀嚼片、微片、片剂、分散片、胶囊、注射剂等。
我国目前有2.2亿儿童(0~14岁),人口基数大,自二胎政策全面实施后,预计儿童人口将进一步增长,然而国内儿童用药市场在药品品种、剂型和规格等方面还是相对匮乏,儿童专用药物占比不足3%,与人口数量的增长极为不匹配,儿童专用药短板亟须补上。
为鼓励儿童药物的研发和生产,国家频频出台系列利好政策、指导原则,为企业开发儿童药物指明方向,基药目录、医保目录重点聚焦儿童药品,倡导优先纳入原则,提高企业研发热情,提升儿童药物的可及性;与此同时,国内综合医院儿科门诊量、儿童医院、妇幼保健院在不断增长;儿科“成团”发展,实现患儿分散就近就医等等。这一系列政策、措施给儿童药市场带来了广阔的需求,预测未来儿童药市场规模将保持年均10%以上的速度增长,千亿儿童药物市场即将迎来前所未有的发展机遇。
-END-
关于我们:
综合信息部由20名成员组成,其中总监1名、经理2名、副经理1名、主管1名、药理专员15名,均来自北京大学、中国医学科学院北京协和医学院等国内外知名院校。综合信息部主要负责公司的国际/国内项目立项、品种市场信息支持、公司知识产权维护及撰写临床/药理相关申报材料,为公司研发提供信息保障。
部门下设5个中心,其中仿创药立项策略中心主要负责仿制药、创新药品种立项;临床&药理中心负责相关申报材料撰写;知识产权中心负责公司知识产权维护;大数据分析中心负责国内外品种信息分析、企业产品管线规划及战略合作伙伴个性化信息支持;国际新产品策略中心关注国际原料药、装置、制剂品种信息,提供中美、中欧双报立项信息。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450