干货 | 如何构建研发管理体系中的QA组织
研发 QA 职责即保证研发质量过程实施的规范性,保证研发数据和资料的可靠性和完整性,产生的实验数据能遵循 ALCOA 原则,保证注册申报项目的顺利获批。通过数据分析[1],建立全面严谨的研发质量管理体系,明确质量目标,充分考虑过程合规性和存在的风险性,防止因程序繁琐导致研发效率低下。
自国家食品药品监督管理总局于2015年7月发布了《关于开展药物临床试验数据自查核查工作的公告》(2015年第117号)以来,促使相关研究单位极大提高了对数据可靠性的重视程度。建立研发 QA 组织,是药品研发企业顺利完成药品监督管理部门对所受理药品注册申请“研制现场核查”、“生产现场检查”、“仿制药质量和疗效性评价”及有因检查所必须设立的部门。
目前国内主要有以下支持研发 QA 的政策法规,及 ICH 指导原则 Q8~Q11[2]。
政策、法规及指导原则列表

研发质量体系建设是一个系统的循环工程,它存在的形式不仅是一套质量体系文件和质量管理部,它更体现了一个企业对质量文化的贯彻实施。
具体选择何种 QA 运行模型,应根据企业的实际情况,充分协调人、技术、过程三者之间的关系,使质量体系能够充分发挥作用,促进企业的可持续发展。根据对一些企业实际情况的调查及实践摸索,本文分别介绍职能型组织结构和矩阵型组织结构中 QA 组织的优缺点。
在职能型组织结构中,各个职能部门可能会设立自己的 QA 岗位。QA 独立于项目组,直接向部门主管报告,但在业务上也向项目经理进行汇报。
-
在职能型组织结构下 QA 组织的优点:
同属于一个部门, QA 人员容易深入项目组的具体工作,容易发现项目的实际问题,项目组对问题的处理也更快捷。
某公司按照此类 QA 运行模式, QA 人员直接下沉到部门,紧密配合部门的管理层开展各项合规性工作,协助部门制定各项内部的管理制度,因地制宜对存在的各类不合规性进行整改与跟踪。
通过该工作方式,实验过程中数据的完整性、现场的合规性得到了很大的提高。现以该公司2021年3月~2022年3月的异常数据指标为例进行效果分析。

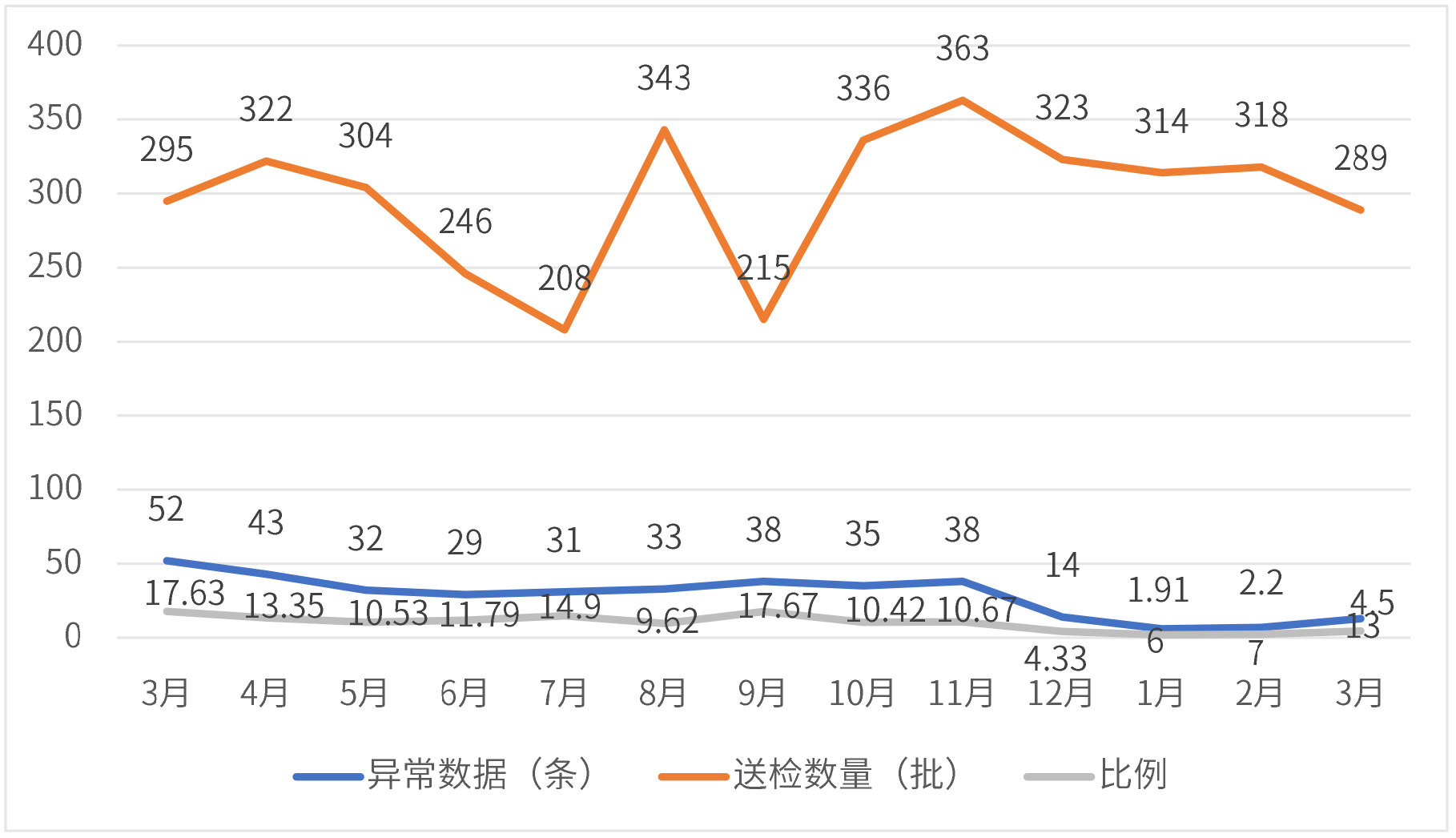
比例=异常数据/送检数量
从上述2021年3月到2022年3月的异常数据可知,自从 QA 下沉部门开展质量体系相关工作后,产生的异常数据的数量先下降,然后维持在一个较低水平。
-
在职能型组织结构下 QA 组织的缺点:
各职能部门相对独立,部门之间缺乏经验交流和共享。不同部门还可能重复进行过程、方法和工具的研究。
在矩阵型组织结构中,企业设立了专门的质保部, QA 人员由质保部指派到各个项目组开展相关工作。QA 独立于项目组和职能部门,在行政上向 QA 经理报告,业务上向项目经理或相关负责人报告。
-
在职能型组织结构下 QA 组织的优点:
✎ 项目经理对 QA 的工作绩效有建议权,但由 QA 部经理对 QA 进行直接考评,以保证 QA 工作的独立性和评价的客观性,也可以保证 QA 组织的长期利益与项目的短期利益之间的平衡。
✎ QA 资源的分配是根据项目特点、工作量和进度而确定的,同时考虑项目优先级,对 QA 人员进行动态调配,保证更加充分地利用资源。
此外,由于 QA 人员直接面对项目组开展工作,涉及到环境设施、现场操作、记录与资料,更容易发现研发体系需改进的“短板”,所以 QA 是改进过程实施的重要推动力量。因此,质保部还担负了企业组织架构及质量体系的优化、过程资产库和数据库的建立、维护和使用等职能。质保部成为 QA 人员的资源池,一方面负责为项目输送研发 QA 人员,另一方面培养 QA 人员专业和质量体系的知识,可以有效避免职能型组织结构中不同部门重复投资于质量体系、忽视 QA 职业发展的问题。
-
在矩阵型组织结构下 QA 组织的缺点:
在矩阵型组织结构中由于 QA 和项目组分别由不同的领导负责,故 QA 较难融入项目组发现深层次问题,而且可能常常遇到 QA 与项目经理很难就一个问题是否成为问题而达成共识的扯皮情况。
对于这种情况,可以通过问题的“上报”机制来解决,即对于 QA 与项目组协商后仍不能解决的问题, QA 可以直接报告职能部门主管和质保部经理,通过高层协商和协调资源来寻求问题的解决。
研发人员眼中的 QA 往往也是“警察”, QA 的作用似乎仅限于发现和报告项目的问题。其实,一个合格的QA在项目中会充当三种角色:
老师:具备学习和培训的能力, QA 辅助项目经理制定项目计划,包括根据质量体系的标准要求及风险评估,设定质量目标;对项目成员进行过程操作和文件撰写等规范培训及指导。
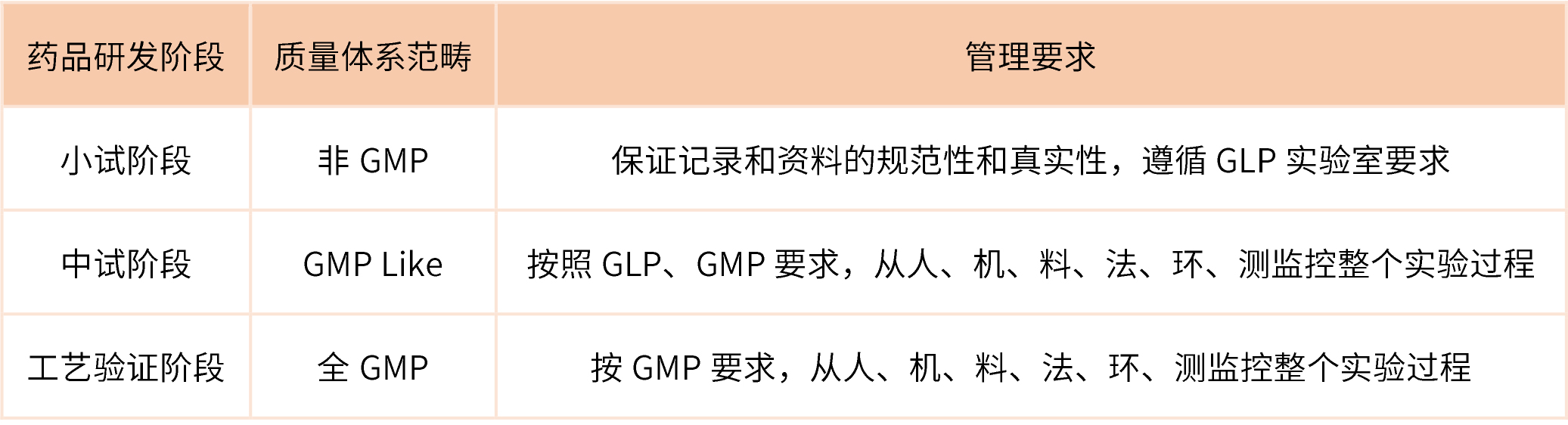
药品的不同研发阶段,对质量体系控制的要求也不同。下表对药品不同研发阶段的质量体系范畴和管理要求进行简述。
不同药品研发阶段管理要求
针对 QA 人员的选择应考虑以下方面:
-
本专业出身,有丰富的专业知识背景和药品注册申报的法规知识,能独立完成相关记录和资料撰写;
-
从事过药品研发和药品生产工作,了解实验和生产的各环节,熟悉仪器设备的维护保养;
-
能将 QbD 的理念运用于工作,统筹安排各项工作;
-
充满自信、正能量,善于去引导和感染别人;
-
具备宽容和包容的品质,善于接受别人的意见和建议,并转化成工作所需;
-
具备良好的沟通交流能力,推动落实管理规范和规程,及时指出执行中存在的问题,并跟踪整改情况。
在药品研发全过程中建立研发质量管理体系,应自上而下达成对研发质量管理的高度重视,在风险评估及 QbD 的理念下把握各阶段各个管理要素的关键点,统筹兼顾,系统全面地制定整个研发过程的质量管理规范和工作流程,助力药品研发过程高效完成,顺利获得药品批件并投产。
新领先成立专门的质量保证部,对药品研发过程进行全面质量管理,公司在2019年通过了 ISO9001 认证,并每年对质量体系进行内审、外审,通过公司和外部质量认证机构的通力合作,推动研发质量体系的持续改进。2021年3月公司分析测试中心多个检测项目通过国家认可委的认可资质,为药品的注册申报保驾护航。公司近5年来接受国家局、省局、市局的药品研制现场检查或生产现场检查多次,均未发生严重缺陷项,现场规范性和资料完整性均得到专家的认可。
参考文献
-
谢炳全. DX公司质量管理体系改进研究 [D]. 南昌:江西财经大学,2019.
-
国家药品监督管理局药品审评中心.Q8~Q11,https://www.cde.org.cn/ichWeb/guideIch/toGuideIch/1/0.
-
国家药品监督管理局食品药品审核查验中心.国家药品监督管理局食品药品审核查验中心关于发布《药品注册核查工作程序(试行)》等5个文件的通告(2021年第30号),https://www.cfdi.org.cn/resource/news/14200.html.
-
国家药品监督管理局.国家药监局关于发布药品记录与数据管理要求(试行)的公告 (2020年第74号),https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20200701110301645.html.
-
国家药品监督管理局.国家市场监督管理总局令第27号.https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/20200330180501220.html.
-
国家药品监督管理局.《药物非临床研究质量管理规范》(国家食品药品监督管理总局令第34号).https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/bmgzh/20170802160401550.html.
-
国家药品监督管理局.总局关于发布仿制药质量和疗效一致性评价研制现场核查指导原则等4个指导原则的通告(2017年第77号).https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20170518144401598.html.
-
国家药品监督管理局.国家食品药品监督管理总局关于发布《药品生产质量管理规范(2010年修订)》计算机化系统和确认与验证两个附录的公告(2015年第54号),https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20150526120001509.html.
-
国家药品监督管理局食品药品审核查验中心.《药品生产质量管理规范》(2010年修订),https://www.cfdi.org.cn/resource/news/5315.html.
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450