划重点!我国保健食品注册和备案须知(附各国保健食品定义与监管区别)
保健食品指的是由特定人群食用,不以治疗疾病为目的,具有保健功能或者以补充维生素、矿物质等营养物质为目的,不对人体产生危害的食品。保健食品与婴幼儿配方食品、特殊膳食食品、特殊医学用途配方食品同属于食品项下的特殊食品。
保健食品法规历史沿革
- 2005-2013年:随着经济发展,保健食品行业初步发展,海外保健食品风靡中国
- 2014年:国务院发布《中国食物与营养发展纲要(2014-2020)》。
- 2015年:新修订《中华人民共和国食品安全法》,实行保健食品的注册与备案分类管理,规定了保健食品原料目录和功能目录。
- 2016年:CFDA发布《保健食品注册与备案管理办法》,实行注册+备案双轨管理。
- 2017年:CFDA发布《保健食品备案工作细则》,备案系统上线;国务院发布《国民营养计划(2017-2030年)》。
- 2019年:国家市场监督管理总局发布《保健食品原料目录和功能目录管理办法》。
- 2020年:首批非营养素补充剂目录上线。
使用保健食品原料目录以外原料(以下简称目录外原料)的保健食品和首次进口的保健食品(属于补充维生素、矿物质等营养物质的保健食品除外)应当提出注册申请,由国家市场监督管理总局批准注册上市。
保健食品注册时需注意:
-
注册人申请人应当是在中国境内登记的法人或者其他组织
-
产品声称的保健功能应当已经列入保健食品功能目录
-
进口保健食品的注册人,应当是上市保健食品境外生产厂商
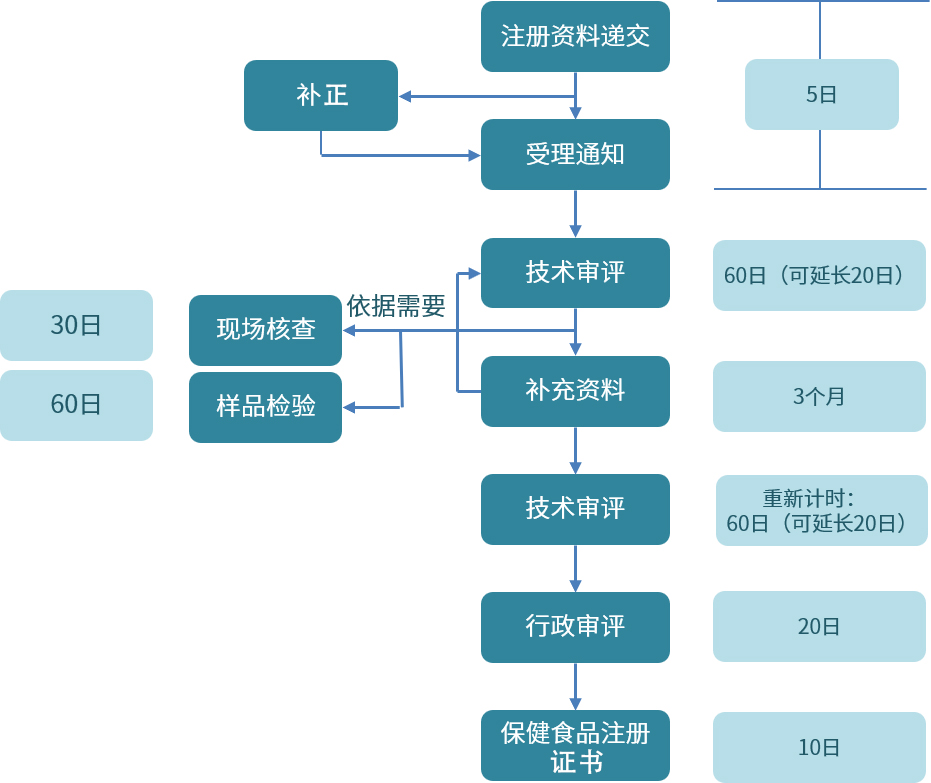
我国保健食品注册流程图
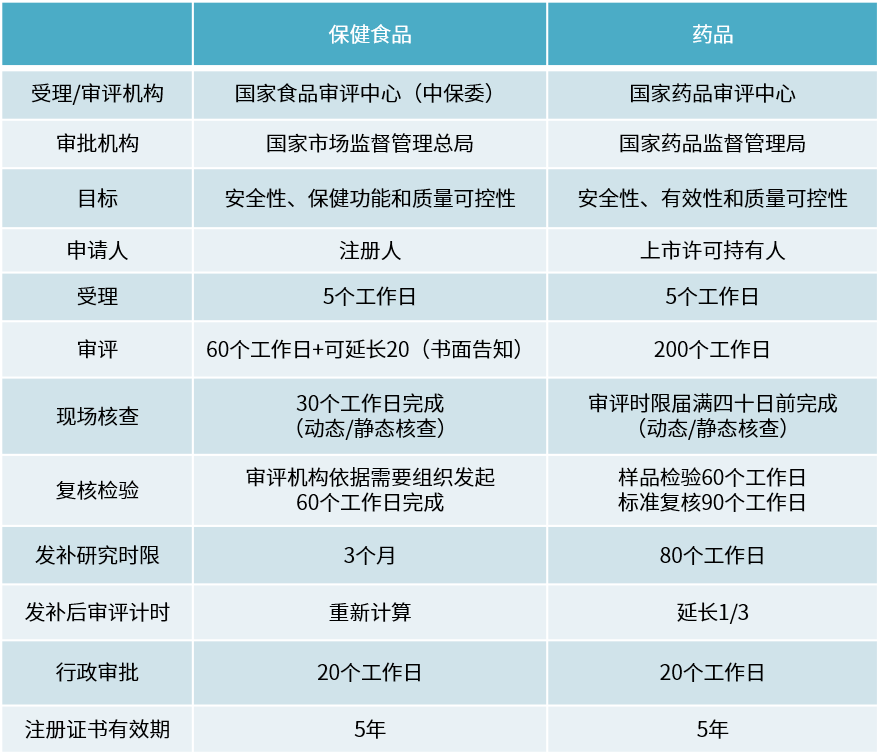
境内生产保健食品注册与药品注册流程对比表
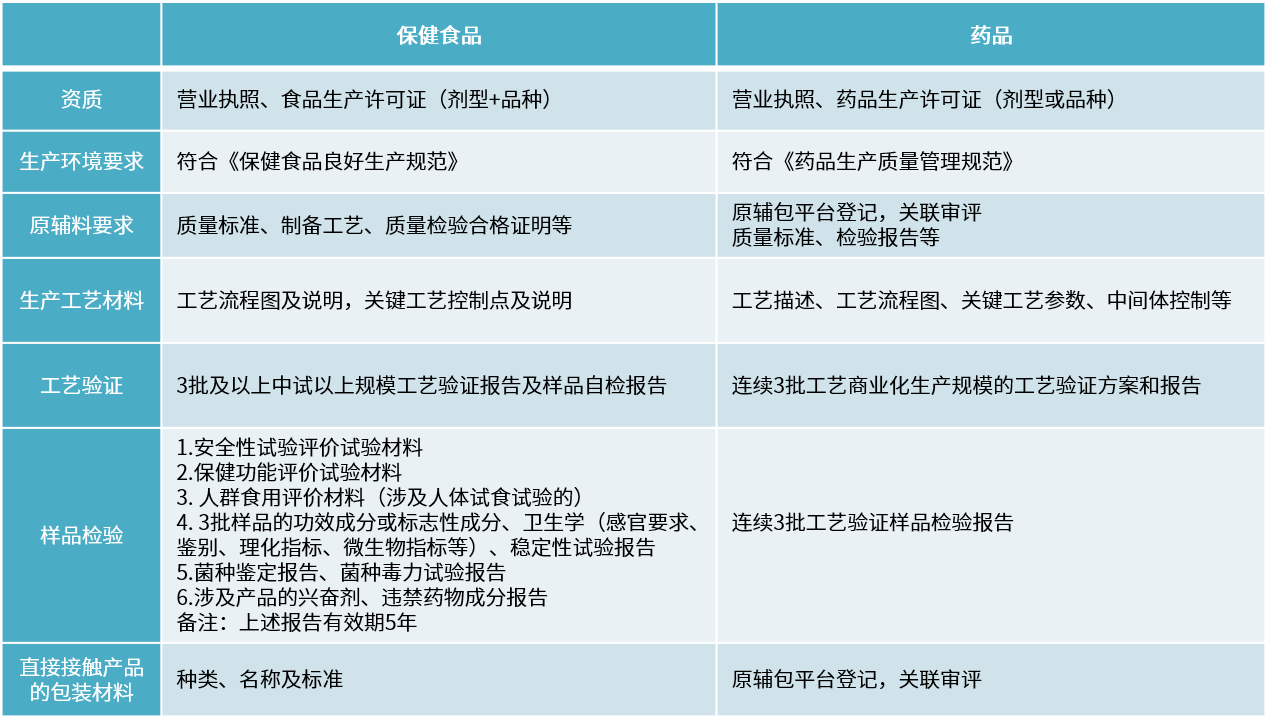
资料要求
-
保健食品注册申请表和申请人对申请材料真实性负责的法律责任承诺书
-
注册申请人主体登记证明文件复印件
-
产品研发报告(研制过程、中试以上验证)
-
产品配方材料(原料和辅料的名称及用量、生产工艺、质量标准)
-
产品生产工艺材料,包括生产工艺流程简图及说明、关键工艺控制点及说明
-
安全性和保健功能评价材料(包括目录外原料及产品的安全性、保健功能试验评价材料,人群食用评价材料,功效成分或者标志性成分、卫生学、稳定性等)
-
直接接触保健食品的包装材料信息
-
产品标签、说明书样稿
-
产品名称中的通用名与注册的药品名称不重名的检索材料
-
3个最小销售包装样品
保健食品与药品部分要求对比
使用的原料已经列入保健食品原料目录的保健食品和首次进口的以补充维生素、矿物质等营养物质为目的的保健食品应当经省市场监督管理局备案。
保健食品备案时需注意:
-
备案人应当是保健食品生产企业,原注册人可以作为备案人
-
进口保健食品的备案人,应当是上市保健食品境外生产厂商
资料要求
-
保健食品备案登记表和备案人对提交材料真实性负责的法律责任承诺书
-
备案人主体登记证明文件复印件
-
产品技术要求材料
-
具有合法资质的检验机构出具的符合产品技术要求全项目检验报告
-
其他表明产品安全性和保健功能的材料
-
产品配方材料(原料和辅料的名称及用量、生产工艺、质量标准)
-
产品生产工艺材料,包括生产工艺流程简图及说明、关键工艺控制点及说明
-
安全性和保健功能评价材料(包括目录外原料及产品的安全性、保健功能试验评价材料,人群食用评价材料,功效成分或者标志性成分、卫生学、稳定性、菌种鉴定、菌种毒力等试验报告,以及涉及兴奋剂、违禁药物成分等检测报告等)
-
直接接触保健食品的包装材料信息
-
产品标签、说明书样稿
-
产品名称中的通用名与注册的药品名称不重名的检索材料
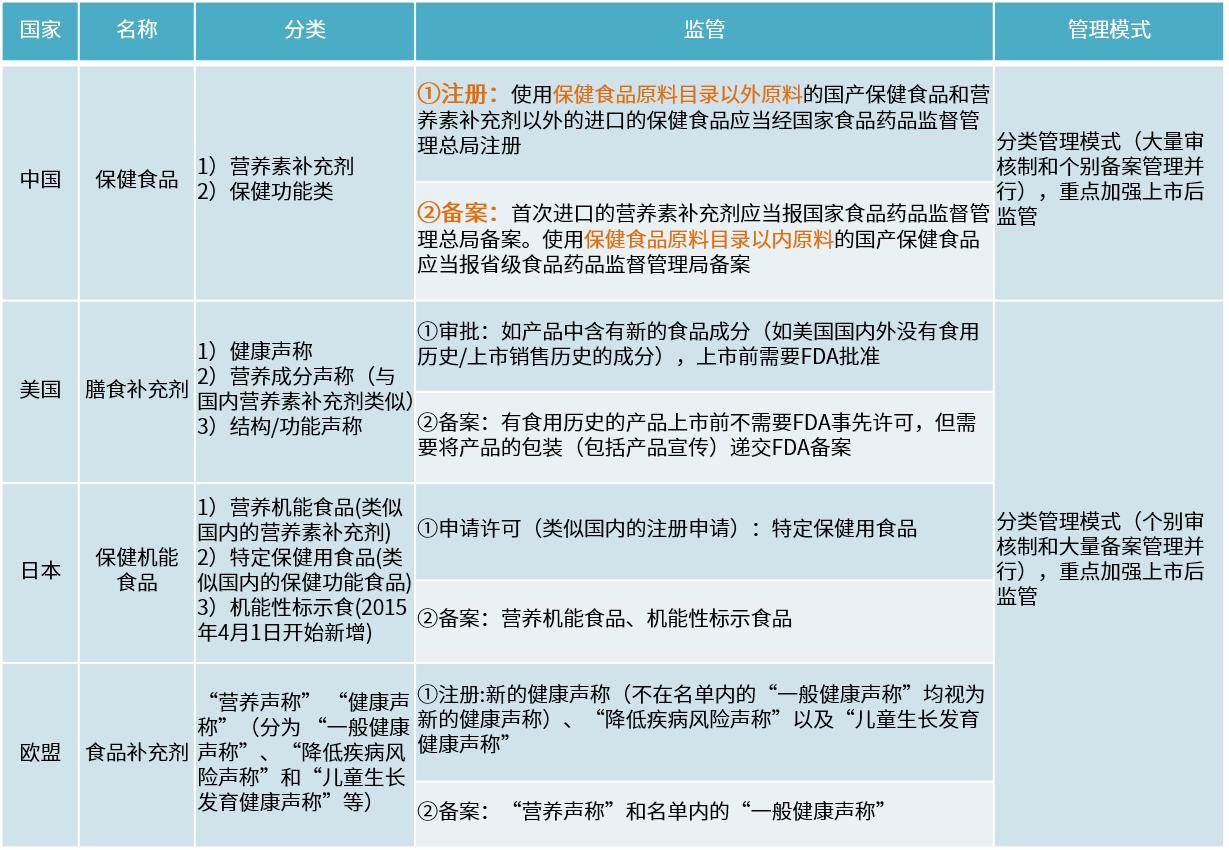
附各国保健食品定义与监管区别:
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450