重点关注 | 终末期半衰期在临床试验中的应用
终末期半衰期可以预测药物积累和达到稳态的时间,是选择合适的给药间隔的主要依据。
-
对于短终末期半衰期药物,维持血浆治疗浓度很重要,这将需要具有低血速率的剂型以获得药时曲线翻转条件(见下文)。
-
对于终末期半衰期较长且药物需要重复给药,则要考虑物蓄积和延迟 达到稳态的问题。
重复给药后的药物浓度-时间曲线(药时曲线)初始呈现以给药间隔为周期的药物浓度逐步积累,随后达到给药间隔期间浓度波动的稳态。
01 单室隔模型的药物蓄积情况
服从单相衰减(单室模型)的药物,其蓄积指数 R(Accumulation Index)计算可采用公式计算:
R=1/[1-(0.5) ^(τ/t1/2)]
R 是对应于稳态时在给药间隔内的曲线下面积(AUCss,τ),与首次给药间隔后的曲线下面积(AUC1,τ)之比,τ 是给药间隔,t1/2 是终末期半衰期。
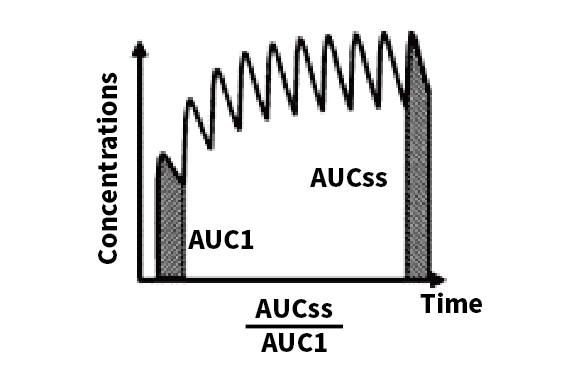
多次给药的药物蓄积有两个决定因素:药物特性的终末期半衰期;医生/患者的用药间隔。因此,药物蓄积指数并非药物的内在特性,而是依赖于药物特性(t1/2)和临床决策(τ)的变量。
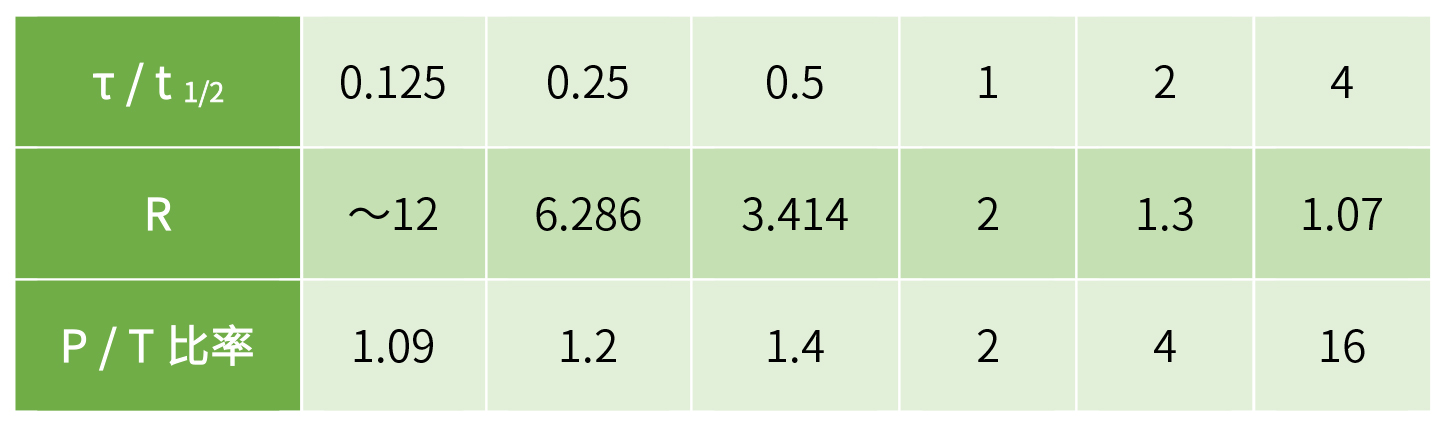
临床上,医生可以通过控制给药间隔以控制蓄积率。如果给药间隔 τ 等于 t1/2,蓄积指数为 2 。其他的稳态蓄积指数情况见下表。
不同给药间隔(τ)和终末期半衰期(t1/2)之比值,与稳态累积指数(R)及峰谷浓度比(P/ T 比)对应表
达稳时间不受给药间隔影响,它只是终末期半衰期的函数。
✎ 对于任何终末期半衰期为12 小时或更短的药物,在每天第二次或第三次给药后将达到稳态。
例如:有以下三种给药方案:
① 每天重复给予剂量100/次,τ=24h;
② 重复给予剂量 50 BID,τ=12h;
③ 静脉给药(iv)100,24h连续输注);
三种方案中,药物在体内会以相同的时间达到稳态,且获得相同的平均浓度 (Css)。实际上,稳态是在3-5个半衰期后获得。
✎ 对于半衰期较长(超过 24 小时)的药物,达到稳态时间过长是一个问题,所以可以在初始给药采用负荷剂量来快速达到稳态血药浓度。从终末期半衰期也可以预测如何给予负荷剂量,即“负荷剂量 (LD)=维持剂量*蓄积指数”。当大部分药物在终末期被消除时,蓄积因子推测的LD,与体积法(即 LD = V ss *C ss )推定的负荷剂量相同。
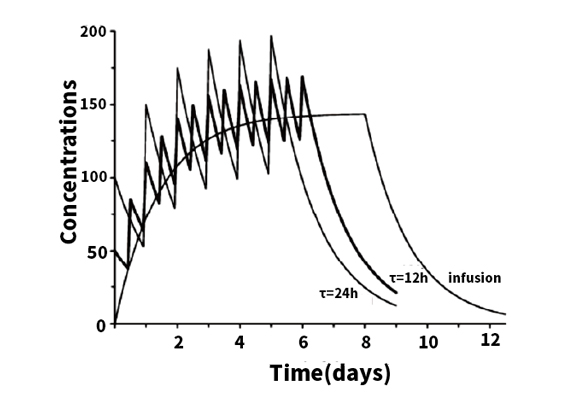
例如:一个终末半衰期为48h的药物,分别以12h和24h为给药间隔给予相同的每日总剂量。
-
无论怎样的给药间隔,都会在终末期半衰期的3-5倍的时间(特别注意:不是3-5次用药后),大约8-10天后达到平台期;
-
不同的给药间隔其对应的累积指数不同,24h 和 12h 的 R 分别为3.414 和 6.286。
从临床角度来看,虽然不同给药方案达稳时间及稳态平均浓度相同,但药物浓度的波动度不同,即峰和谷间的浓度差异不同。
稳态下的血浆浓度-时间曲线以一系列峰浓度和谷浓度为特征。给药间隔内的这些波动由 τ 和 t1/2 控制,峰谷浓度比(P/T比)是 τ 和 t1/2 的函数:
P/T = Cmax,ss/ Cmin,ss = 2^(τ/ t1/2)
其中,Cmax, ss和C min, ss分别是稳态峰和谷浓度。
终末期半衰期和给药间隔之间的关系决定了给药间隔期血药浓度的波动幅度。如果给药间隔相对于终末期半衰期较大,则浓度有较大波动,可能因 Cmax 太高而产生副作用,或因 Cmin 太低无法维持疗效。
✎ 对于治疗窗较窄(抗心律失常药、抗癫痫药等)、选择性差(NSAID 类的 Cox1 与 Cox2 抑制剂)的药或应维持在某阈值以上的药物(抗心律失常药物、抗生素等),除了药物剂量以外,合适的半衰期和给药间隔的配比就显得非常重要。
例如:某药物 A 假设临床药效需要在药物浓度 2ng/mL 以上才能维持,同时浓度超过 2.5ng/mL 时不良反应的可能性会增加,浓度上限和下限的比值=2.5/2=1.25。
需要对比选定的给药方式下的平均稳态浓度,和稳态时的波动比(P/T比)进行比较,保证P/(P/T)比必须小于1.25。反过来,从对应表中可以看到,τ/ t1/2比为 0.25 时,对应的 P/T 比为 1.2 ,也满足上述要求,则可以设定为给药间隔为终末期半衰期的1/4。
-
实际情况远比上述简单推算复杂很多,例如药物靶点位于血浆隔室之外,其影响可能与血浆浓度间接相关,特别是很多生物药。此时,给药方案的设计最佳策略是使用 PK/PD建模去模拟。
当药物处置呈现多相分布时,在消除的终末期半衰期之前,存在几个对应于不同分布阶段的半衰期。而某种程度上,每个半衰期都是分布、再分布和消除的函数。实际上,当至少 50% 的药物在终末衰变阶段被消除时,终末半衰期才对药物蓄积产生重要影响。反之,则可能无关紧要。
例如:A,B 两种药物的 PK遵循双室模型,并具有相同的终末期半衰期(48h),但总药物被终末期被消除后剩余的剂量占比有所不同(药物 A 低,药物 B 高)。
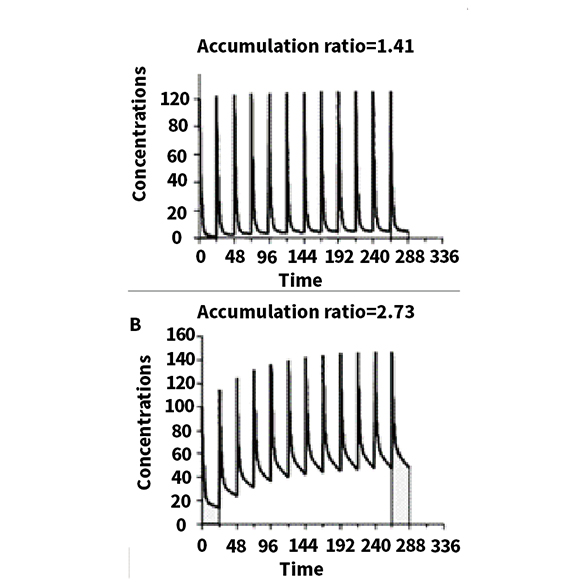
从图中发现,A 药物大部分消除发生在分布阶段,而对于 B 药物的消除,其终末阶段则比较重要,A 药更快地达到表观稳定状态,B 药则要约4个半衰期才能达到稳态。
事实上,当前的多数药物都有多相(中央隔室和几个外围隔室)药代动力学特征。对于这些药物,了解药物在血浆及外周隔室蓄积程度很重要,特别是靶点在瘤灶的生物药。
-
如果将外周隔室简单划分为浅室和深室,会发现在浅隔室中,达到伪平台要快得多,相当于该部位与血浆可以建立快速平衡,此时浅室的药理/毒理学效应可以等同于表征稳态条件的效应。
-
相反,在深室中的药物蓄积多且渐进,该局部作用会随着时间的推移而继续增加。
下图可以示意在深隔室中达到稳态的延迟现象,且这个现象是由终末期半衰期控制的。
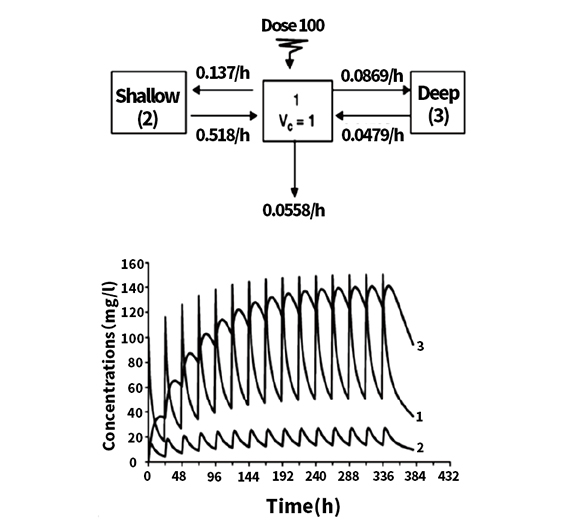
血管外 (EV) 给药终末期半衰期可能比静脉给药更长。除普通的口服药外,还存在许多长效制剂(如:缓释控释剂型、皮下植控释等)或不同的给药途径(如皮下、肌肉注射,透皮给药等)药物,它们会将血浆浓度维持在治疗浓度以上来提供更长的作用持续时间。
与静脉给药非常不同,所有上述制剂、剂型等,终末期半衰期不仅受制于药物消除率和分布容积,也受到生物利用度因素(速率和吸收程度)的控制,特别在吸收速率为药物吸收和消除顺序过程中的限速步骤时(即药物在被吸收之前不能被消除)。此时,吸收速度可能比消除速度慢,导致 t1/2 取决于吸收速度而不是消除速度。这种现象被称为“翻转”(Flip-Flop),在渗透性或溶解度特别差的分子药物中可能会发生。
合理的新药开发过程应当要求:无论其预期的最终上市制剂及给药途径如何,都应该进行 I.V 途径的药代动力学研究,以确定该物质本身的确切终末期半衰期。
终末期半衰期是对分析技术性能最敏感的参数,尤其是定量下限 (LOQ)。所以,经常会发现不同时期所报告(文献或说明书)的终末期半衰期的参数(以及其他药代动力学参数)受分析技术性能的影响,尤其是受定量水平 (LOQ) 的影响,有不小的差异。
参考文献:
-
Donglu Zhang, et al.Drug Concentration Asymmetry in Tissues and Plasma for Small Molecule–Related Therapeutic Modalities.Drug Metabolism and Disposition ,2019, 47 (10) 1122-1135.
-
Dennis A. Smith, et al.Relevance of Half-Life in Drug Design.J. Med. Chem. 2018, 61, 10, 4273–4282.
-
Toutain, P.L. et al.Plasma terminal half-life. Journal of Veterinary Pharmacology and Therapeutics,27(6):427-439.
-
Toutain, P.L. et al. Plasma clearance. Journal of Veterinary Pharmacology and Therapeutics, 27, 415– 425.
-
Toutain, P.L. et al. Volumes of distribution. Journal of Veterinary Pharmacology and Therapeutics, 27, 441– 453.
-
Selma Sahin & Leslie Z. Benet. The Operational Multiple Dosing Half-life: A Key to Defining Drug Accumulation in Patients and to Designing Extended Release Dosage Forms. Pharmaceutical Research.2008,25:2869–2877
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450