收藏 | 全过程!滴眼液研究内容要点及注意事项
滴眼剂系指由原料药物与适宜辅料制成的供滴入眼内的无菌液体制剂,其生产和质量要求一般参考注射剂的技术要求。本文结合《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等相关要求,具体阐述滴眼液研究过程中的研发内容及注意事项。
- 载入《仿制药参比制剂目录》的品种,按照参比制剂目录进行选择。
- 尚未收载入《仿制药参比制剂目录》的品种,药品上市许可持有人应当按照《国家药监局关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)申报参比制剂,待参比制剂确定后开展研发申报,避免出现因参比制剂选择与国家公布的参比制剂不符,影响研究项目开展、造成资源浪费等问题。
当拟研发药品规格(包装规格)与所公布参比制剂不一致情况,应提出进一步评估风险后再进行开发,如有必要,可同步进行备案。
一般应至少采用3批仿制制剂与参比制剂进行物理化学特性(Q3)对比,用于对比研究的仿制制剂应与商业化批次在同一生产线上生产。在工艺验证之前,应有2个批次参比制剂研究结果(最少需要1批研究结果),以便再次确认研发目标的可靠性。
研究内容包括:
关键质量属性剖析:包括性状、澄清度与颜色、pH值、装量或最低装量、渗透压摩尔浓度(比)、有关物质(异构体)、含量、抑菌剂含量、稳定剂含量(如有)等,同时还需重点对参比制剂黏度、比重(相对密度)、滴出量、缓冲容量进行剖析。
稳定性研究:影响因素、低温冻融、加速、中间、长期等,应注意该类品种包装为半渗透性包材,需要低湿度稳定性箱。考察指标除以上关键质量属性外,还需重点关注失水率。
其他:包材反向剖析,确定包材材质和尺寸;原辅料用量剖析或确认。
实验室研究前信息确认
通过文献、上市说明书以及参比制剂剖析结果,对制剂的适应症、剂型、规格、用法用量、药代动力学、有效期、包装系统等信息进行前瞻性总结,并进行合理性说明,需要调研是否在FDA或EMA有各药指南(如有)。
药品质量属性包括但不限于以下内容:性状、鉴别、检查[澄清度、颜色、pH值(眼睛可耐受的pH范围为5~9)、渗透压摩尔浓度(与泪液等渗)、装量、抑菌剂(通常多剂量包装需加入抑菌剂,单剂量包装不得加入抑菌剂)、稳定剂(如有)、可见异物、不溶性微粒、无菌、有关物质(异构体)、含量等。
▧ 注意失水率、比重(相对密度)、黏度、滴出量、缓冲容量、抑菌效力的测定,以有效控制滴眼剂的质量。
判定标准:是否属于关键质量属性取决于当该质量属性超出可接受范围时由风险评估获得的该属性对临床有效性和安全性的影响程度和不确定性。内容应当包括:药品质量属性,范围,是否为CQA,合理性说明,质量控制风险级别。
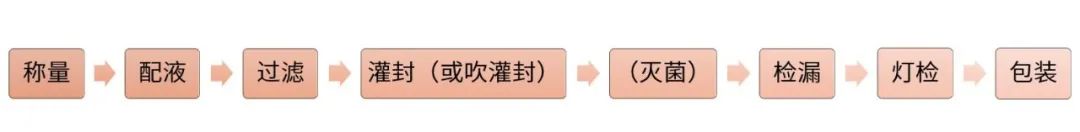
制备工艺流程
工艺参数:
✎ 配液:是否充氮、配液温度、加料顺序、是否避光、pH调节范围、中间体药液稳定性。
✎ 过滤:过滤材质。
✎ 灭菌:灭菌参数(根据物料性质及包材材质确定)。
✎ 检漏:容器密封完整性验证,确定检漏参数。
▧ 滴眼剂包装容器应无菌、不易破裂,其透明度应不影响可见异物检查。除另有规定外,眼用制剂应遮光密封贮存。眼用制剂(含有抑菌剂)在启用后最多可使用4周。除另有规定外,每个容器的装量应不超过10ml(通则0105)。
实验室研究
进行原料药与参比制剂杂质谱对比研究,初步判断原料药的质量情况(工艺杂质及降解杂质剖析)并进行原料药来源筛查。
✎ 不同温度、pH下的溶解度和溶解速度(根据原料药溶解性确定)。
✎ 吸湿性曲线考察。
✎ 稳定性研究:若原料药贮存条件为低温,以有关物质及水分为指标考察恢复至室温贮存时限等。
基于参比制剂说明书、原研专利、公开审评报告等披露的处方信息,结合参比制剂辅料用量剖析结果拟定自制品处方。
原辅料来源与厂家提前沟通(原则上选用已有登记号且同意授权的原辅包,如未登记,需确认物料供应商登记和授权情况)。
如有缓冲剂,需对自制品的缓冲能力进行测试,不低于参比制剂。
多剂量眼用制剂一般应加适当抑菌剂,尽量选用安全风险小的抑菌剂(与参比制剂一致),产品标签应标明抑菌剂种类和标示量。抑菌剂用量参照参比制剂用量加入,并在此基础上设计低抑菌剂浓度梯度处方(可参照质量标准拟定的抑菌剂含量下限),对抑菌效力进行考察,确保稳定性期间的抑菌剂含量具有足够的抑菌效力。
基于相容性风险评估至少应该包括以下实验设计,并进行高温和光照条件样品放置。研究包括:原料药+溶剂;辅料+溶剂;原料药+辅料+溶剂(关注辅料与原料药的相互作用)。具体品种可参照《溶液型制剂原辅料相容性研究操作规程》。
根据原料药性质进行以下研究设计:
✎ 初始注射用水加入量的确定、配液温度范围、是否充氮(对氧敏感的单剂量滴眼液)、加料顺序、是否避光、pH值调节范围、中间体药液稳定性。
✎ 原辅料若存在结块现象,影响溶解过程,可考虑增加粉碎过筛工艺,并考察粒径对溶解时间的影响并做相应研究,粒径范围写入工艺规程。
根据溶液的性质进行以下材质研究设计。需提前与厂家确认滤芯材质,滤芯(如PES,PVDF,Nylon,PTFE等)。以过滤效率、含量、滤芯初步相容性为评价指标,初步确定滤芯材质。
药液的黏度及参比制剂装量范围,确定自制品灌装范围(结合厂家实际生产设备情况)。
根据参比制剂包材剖析结果尽量选择材质一致的包材,材质为塑料瓶+塑料盖,塑料是半透性材料,会透过氧气、二氧化碳、水蒸气等,需关注失水率,同时考察不同来源包材对制剂质量的影响。
制剂灭菌:与注射剂不同的是,滴眼剂大多因为包材的限制(聚乙烯材质),无法采用终端灭菌工艺,而这一点也是可以被认可的。滴眼液的除菌方式一般采用除菌过滤。国外有很多将药液在配液罐中高温灭菌后再无菌分装的操作,但国内不会做此要求。
待小试样品获得至少1个月的加速条件稳定性和影响因素样品检验结果,且质量变化与参比制剂变化趋势一致(包括抑菌剂和稳定剂含量变化),可开展小试放大,重点关注放大效应。
✎ 初步稳定性考察及确定:包括影响因素试验(包括低温、冻融)、加速、中间、长期(具体根据品种特性确定放样条件)、开瓶稳定性(多剂量包装)。
✎ 生产组件相容性及吸附性初步研究: 硅胶管、垫片、不锈钢等生产组件与溶液进行充分接触,并设计不同时间点取样,确认药液与生产组件的相容性。
✎ 分析方法初步验证完成:进行方法确认,时间允许可进行初步方法学验证,如关键耐用性及专属性试验,确定质量标准和分析方法SOP。
根据各国药典质量研究方法的对比以及小试处方工艺的研究结果,制定最终的标准(原辅料,包材,中间产品,成品),分析方法(中间产品,成品),处方(处方种类,数量,物料来源)及工艺(详细的制剂制备工艺)及各个步骤关键工艺参数,完成工艺规程和质量标准备案。
中试放大(GMP)
确定场地及检测设备无问题,同时与生产场地确认其设备验证及无菌验证是否均完成验证,且是否在有效期内。
包括包材的清洗灭菌、配液参数、过滤参数及排液量、灌装稳定性及针头排液量、中间体存放时限等,关注放大效应。
除关键理化性质外,重点关注无菌。
待小试处方确定或中试完成后,可启动滤芯相容性验证(可提取物、浸出物分析、化学兼容性、细菌挑战试验、润湿完整性验证)、包材相容性方法学研究、容器密封性方法学研究(获得中试样品后)、生产组件相容性方法学验证以及抑菌效力验证。
工艺验证(GMP)
待小试处方确定或中试完成后,可启动滤芯相容性验证(可提取物、浸出物分析、化学兼容性、细菌挑战试验、润湿完整性验证)、包材相容性方法学研究、容器密封性方法学研究(获得中试样品后)、生产组件相容性方法学验证以及抑菌效力验证。
2010版中国药典首次规定滴眼剂为无菌制剂,《药品生产质量管理规范》(2010年修订)也相应提高了对滴眼剂作为无菌药品的生产质量管理要求。
无菌药品的生产工艺一般分为最终灭菌工艺和无菌生产工艺。由于目前滴眼剂瓶材质多为低密度聚乙烯、聚酯类等,在高温下易变形,因此滴眼剂一般不能采用最终灭菌工艺,需要采用非最终灭菌的无菌生产工艺进行生产。
根据原料药性质进行以下研究设计:
✎ 技术转移前获得厂家全部设备验证及无菌验证(包括培养基模拟灌装验证)报告,且均在有效期内。
✎ 多剂量滴眼液,技术转移前需获得抑菌效力验证报告。
✎ 技术转移批物料到位后,推进厂家提供物料清单,完成确认。
✎ 获得验证批物料检测报告,完成复核。
根据原料药性质进行以下研究设计:
✎ 关键参数的验证及中间体存放时限验证。
✎ 除菌过滤系统验证。
✎ 包材及容器具存放时限验证(若需和工艺验证同步完成)。
✎ 样品全检及正式稳定性研究。
根据原料药性质进行以下研究设计:
待获得工艺验证合格样品后,可进行包材相容性及生产组件相容性、容器密封完整性批样品检验,及安全性评估试验(包括眼部刺激、过敏试验等)。
对于真溶液型滴眼剂,因不存在药物的溶出和释放过程,美国、欧盟、中国和日本的要求均基本一致,一般要求为:
✎ 当仿制制剂与参比制剂的浓度规格一致、辅料种类(Q1)和辅料用量(Q2)一致(用量一致是指仿制制剂与参比制剂的辅料用量差异在±5%范围内)、物理和化学特性(Q3)对比结果符合要求时,即可豁免体内生物等效性试验。
✎ 如果仿制制剂与参比制剂辅料种类不一致或辅料用量与参比制剂差异大于5%、或Q3)对比数据不一致,则需进行适当的体内生物等效性试验。
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450