科普 | 我国药品信息化追溯体系制度建设
发布时间:2023-04-26
药品信息化追溯体系指的是药品上市许可持有人、生产企业、经营企业、使用单位、监管部门、消费者等药品追溯参与方,通过信息化手段,对药品生产、流通、使用等各环节的信息进行追踪、溯源的有机整体。本文结合政策法规,对药品信息化追溯体系制度、相关发展历程等内容进行分享。
药品信息化追溯体系分为药品追溯系统、药品追溯协同服务平台、药品追溯监管系统三个部分。
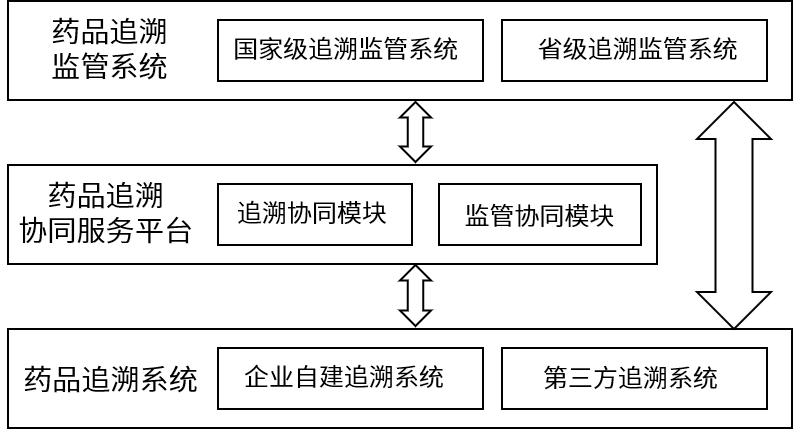
▲ 药品信息化追溯体系构成框架
以药品追溯系统为基础,由药品上市许可持有人自建或第三方服务商帮助企业建立,并向药品流通、经营企业、药品使用单位提供使用;药品追溯协同服务平台相当于连接枢纽中心,与国家监管追溯平台对接,实现动态追溯。如果涉及进出口业务,需与国际平台对接。
02 药品信息化追溯体系建立发展脉络
我国药品追溯体系的建立历经近20年的时间,从对疫苗、麻醉药品、精神药品、血液制品等特殊药品和国家集中采购药品实现“一物一码,物码同追”;到基本药物、医保报销药物等消费者普遍关注的产品,正逐步完善药品信息化追溯体系。
2006: 我国对麻醉药品和第一类精神药品实行电子监管。
2008: 对第二类精神药品和部分高风险药品生产出厂、流通的动态监控,确保药品真实、可追溯。2008.11.01起,对“四大类”高风险产品(血液制品、疫苗、中药注射剂和二类精神药品)实施电子监管。
2010: 电子监管范围扩大到307种基本药物。要求2011.04.01起,列入基本药物目录的品种,未入网及未使用药品电子监管码统一标识的,一律不得参与基本药物招标采购。
2015: 2015年12月31日前,境内药品制剂生产企业、进口药品制药厂商以及所有药品批发、零售企业须全部入网。2016年1月1日后生产的药品制剂应做到全部赋码。
2016: 以推进药品全品种、全过程追溯与监管为主要内容,建设完善药品追溯体系;继续推进药品追溯系统的建立和完善,鼓励药品生产经营者运用信息技术建立药品追溯体系;鼓励行业协会组织企业搭建药品追溯信息查询平台,为药品生产经营者提供数据共享,为公众提供信息查询。
2018: 明确要求药品上市许可持有人、生产企业、经营企业、使用单位通过信息化手段建立药品追溯系统,及时准确记录、保存药品追溯数据,形成互联互通药品追溯数据链。
2019: 新《药品管理法》正式生效,第十二条明确指出国家建立健全药品追溯制度。
2020: 于2020年12月31日前,基本实现国家药品集中采购中选品种、麻醉药品、精神药品、血液制品等重点品种可追溯。
2022: 药品上市许可持有人应当建立并实施药品追溯制度,按照规定赋予药品追溯标识,建立信息化追溯系统;“十四五”期末需构建完善的药品智慧监管技术框架,健全药品信息化追溯体系,实现药品重点品种可追溯。
03 药品信息化追溯体系—药品追溯码
药品追溯码作为药品信息化追溯体系的直接体现,如同药品的电子身份证号码。要求一物一码,物码同追,能够确保药品生产、流通和使用全过程来源可查、去向可追;有效防范非法药品进入合法渠道;确保发生质量安全风险的药品可召回、责任可追究。具有实用性、唯一性、可扩展性、通用性的特点。
药品追溯码用于唯一标识药品各级销售包装单元的代码,由一列数字、字母和(或)符号组成,包含药品标识码和生产标识码。
❖ 药品标识码:用于标识特定于某种与药品上市许可持有人、 生产企业、药品通用名、剂型、制剂规格和包装规格对应的药品的唯一性代码。
❖ 生产标识码:用于识别药品在生产过程中相关数据的代码。
参考文件
《药品信息化追溯体系建设导则》
《药品追溯码编码要求》
《疫苗追溯数据交换基本技术要求》
《疫苗追溯基本数据集》
《药品上市许可持有人和生产企业追溯基本数据集》
《药品经营企业追溯基本数据集》
《药品使用单位追溯基本数据集》
《药品追溯消费者查询基本数据集》
《药品追溯数据交换基本技术要求》
《药品追溯码标识规范》
《药品追溯消费者查询结果显示规范》
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。




 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450