汇总 | 人类遗传资源管理申报指南

为有效保护和合理利用我国人类遗传资源,维护公众健康、国家安全和社会公共利益,我国制定了《中华人民共和国人类遗传资源管理条例》,本文结合该文件,针对人类资源管理申报相关内容与各位读者进行分享。
人类遗传办申报资料可根据类型分为采集审批、材料出境审批、保藏审批、信息对外提供或开放使用备案、国际合作科学研究审批、国际合作临床试验备案六类。各类型分别针对不同的适用范围,在进行申报时要有清晰的认知。
-
采集审批:在中国境内从事中国人类遗传资源采集活动,包括重要遗传家系;特定地区人类遗传资源;国务院科学技术行政部门规定种类、数量的人类遗传资源的采集活动
-
材料出境审批:利用中国人类遗传资源开展国际合作科学研究,或者因其他特殊情况确需将中国人类遗传资源材料运送邮寄、携带出境
-
保藏审批:在中国境内从事中国人类遗传资源保藏活动、为科学研究提供基础平台的事项
-
信息对外提供或开放使用备案:将人类遗传资源信息向外国组织、个人及其设立或者实际控制的机构提供或开放使用
-
国际合作科学研究审批:利用中国人类遗传资源开展国际合作科学研究
-
国际合作临床试验备案:为获得相关药品和医疗器械在我国上市许可,在临床机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源材料出境
-
重要遗传家系:患有遗传性疾病或具有遗传性特殊体质或生理特征的有血缘关系的群体,患病家系或具有遗传性特殊体质或生理特征成员五人以上,涉及三代。
-
特定地区人类遗传资源指在隔离或特殊环境下长期生活,并具有特殊体质特征或在生理特征方面有适应性性状发生的人群遗传资源。特定地区不以是否为少数民族聚居区为划分依据。
-
国务院科学技术行政部门规定的种类是指罕见病、具有显著性差异的特殊体质或生理特征的人群: 规定数量是指累积500人以上。
-
保藏:将来源合法的人类遗传资源保存在适宜环境条件下,保证其质量和安全,用于未来科学研究的行为。
该部分分别以上述六种类型对人类遗传资料清单进行汇总,详见下图。
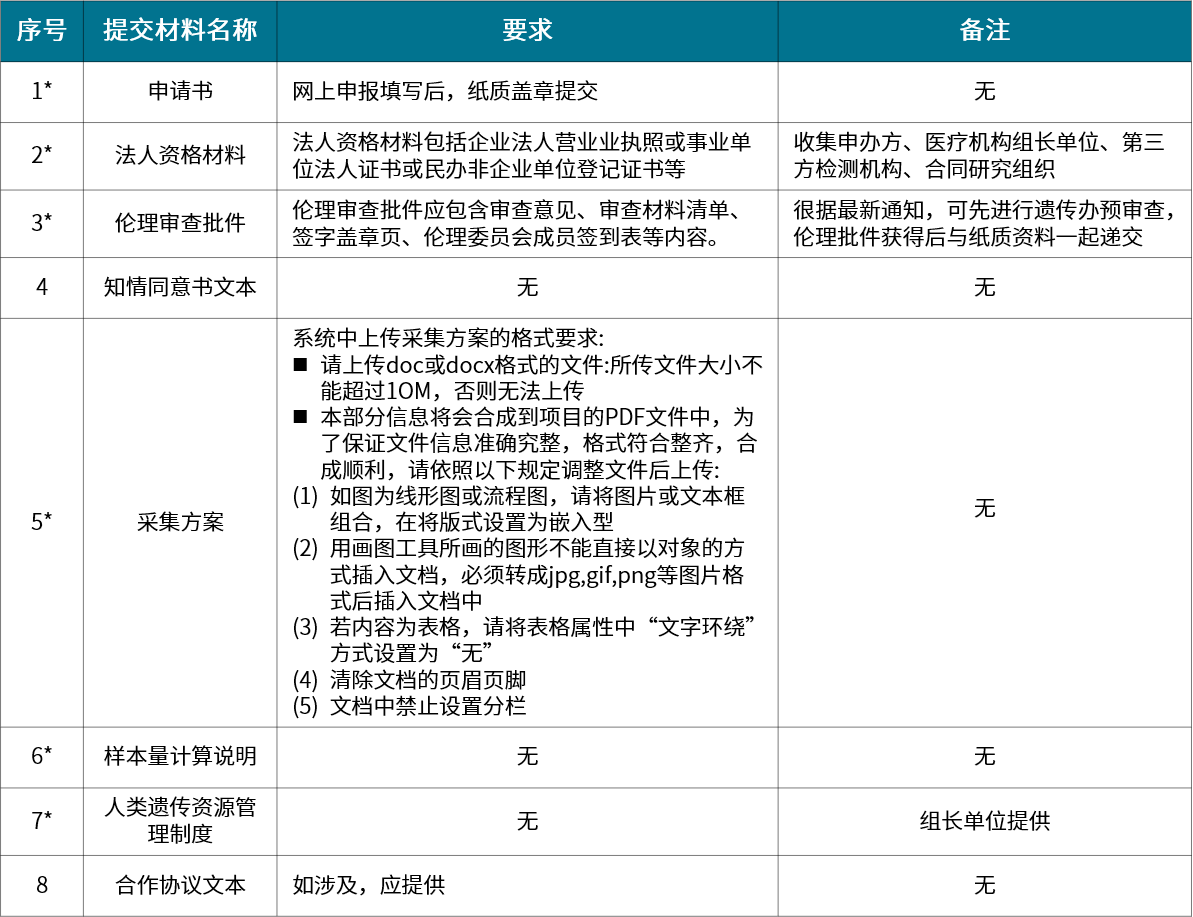
▲ 采集审批材料清单
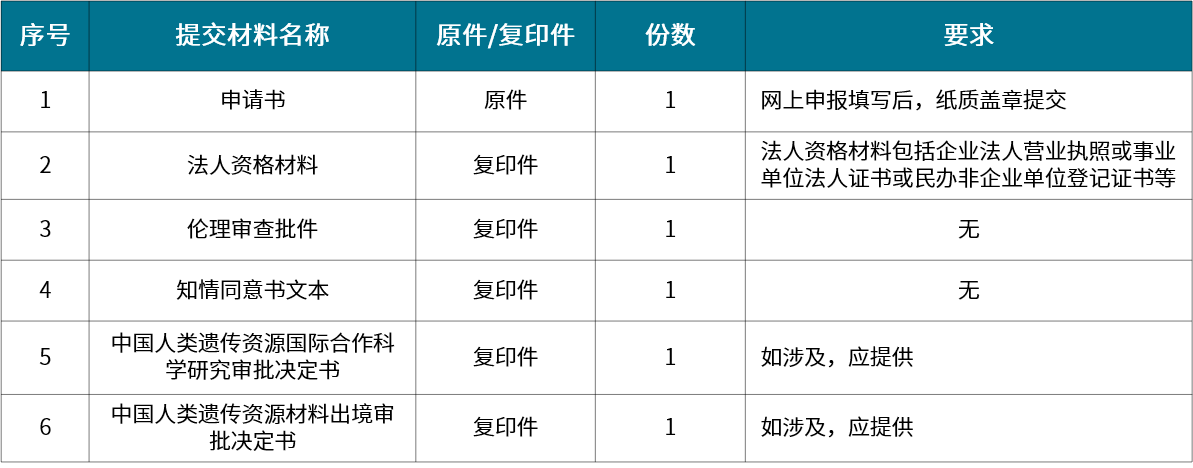
▲ 材料出境审批材料清单

▲ 保藏审批材料清单
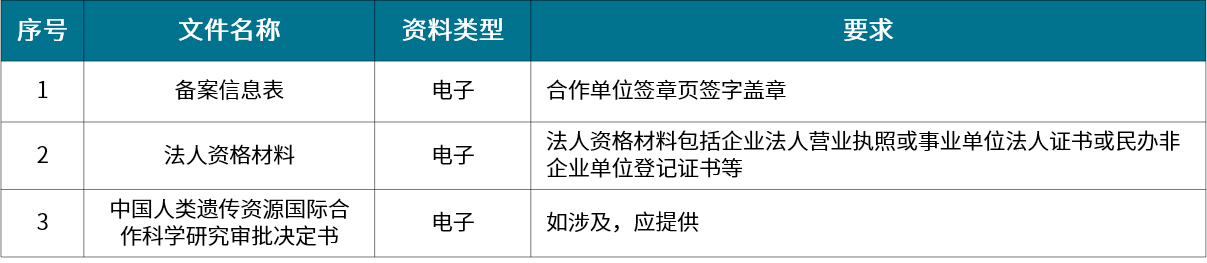
▲ 信息对外提供或开放使用备案
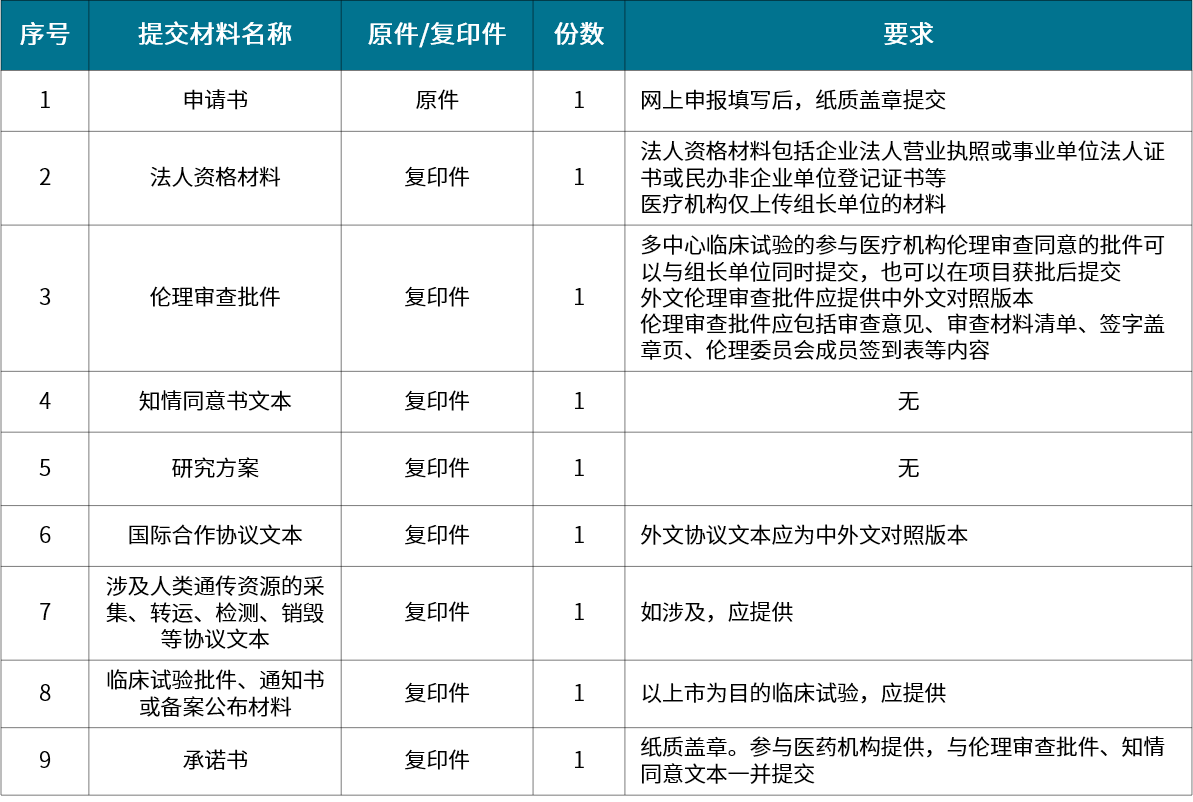
▲ 国际合作科学研究审批申请材料清单
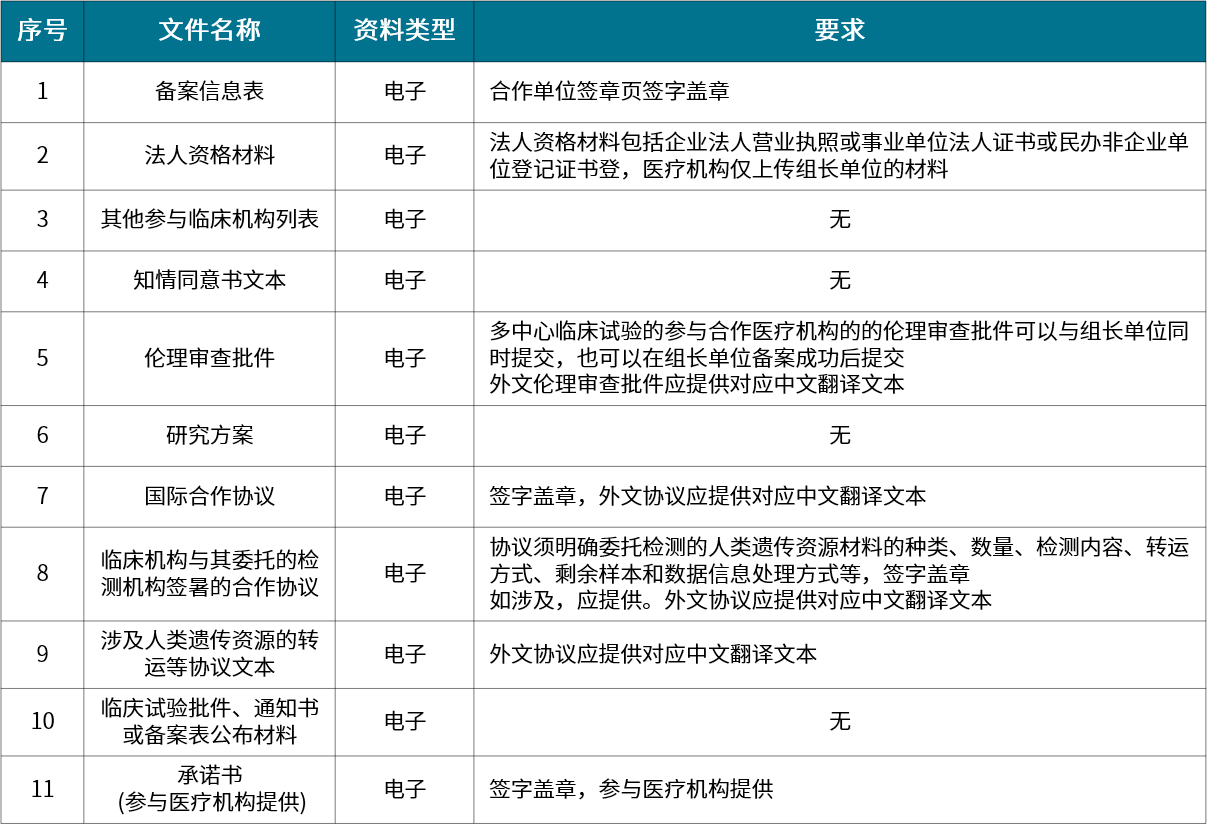
▲ 国际合作临床试验备案材料清单
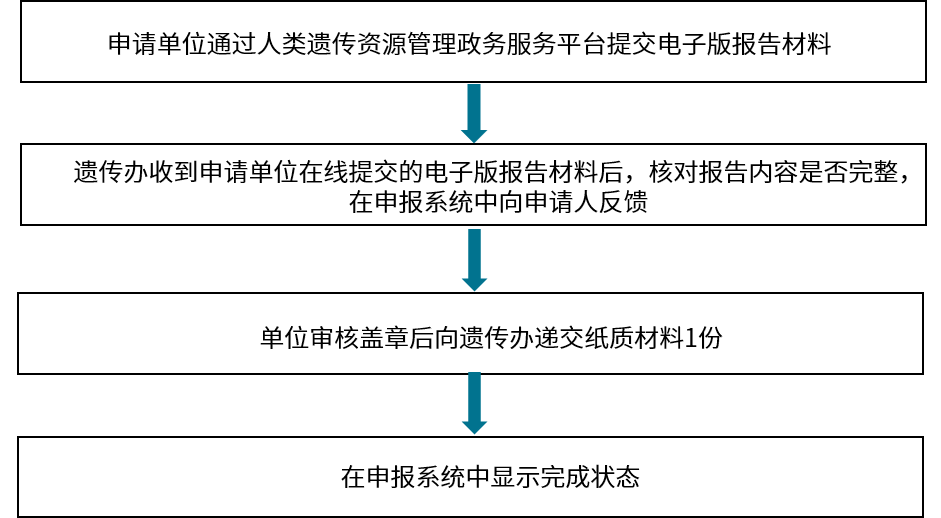
该部分主要针对采集、国际合作审批申报、备案及报告提交流程进行整理汇总。


北京新领先 · 深蓝海(郑州)
深蓝海生物医药是新领先在临床 CRO 领域的子品牌,成立于2007年,目前已拥有高专业水准的临床服务团队600余人,已为300余家国内外知名企业提供多元化的研发支持临床技术服务,项目全面覆盖生物药、化药、中药、医疗器械、细胞与基因治疗等药物,满足不同研发型企业的临床研究定制需求,为国内外客户打通新药上市前关键瓶颈。
通过16年经验积累,深蓝海生物医药已经完成临床研究500余项,每年开展Ⅰ类创新药研究10-20项,率先开展医美、特医食品、细胞与基因治疗药物等领域研究,填补国内外多项空白。
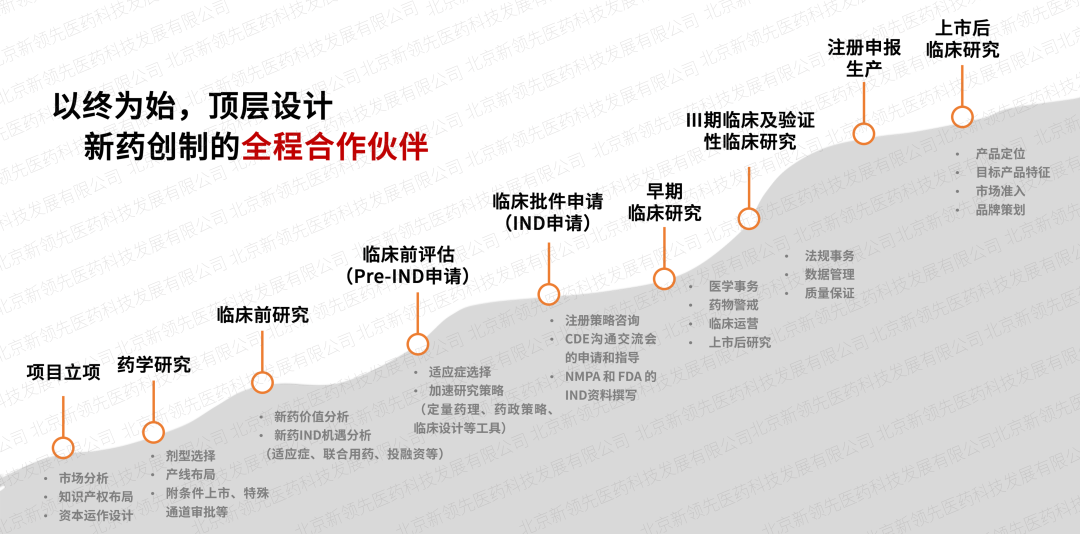
依托于新领先CXO服务体系,创建了“交互式”临床服务模式,在项目立项阶段全面介入,做新药创制的全程合作伙伴,整合医学、药政、药学研发等技术专家进行顶层设计,最大限度降低项目研发风险。同时,成立专项政府引导基金,为创新项目提供不同阶段的投融资,最大程度加速药品上市进程。此外,强大的定量药理学及体内外桥接团队针对特定疾病和特定人群进行数字模型研究,制定科学高质的临床研究方案,提高新药临床开发效率。
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450