政策法规||假期作业如期而至,本周重磅法规概览(20.12.28-12.31)
CDE
01
关于发布《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》的通告(2020年第53号)

02
关于发布《治疗脂代谢紊乱药物临床试验技术指导原则》的通告(2020年第68号)

03
关于发布《单纯性尿路感染抗菌药物临床试验技术指导原则》等5个指导原则的通告(2020年第69号)

04
关于发布《儿科用药临床药理学研究技术指导原则》的通告(2020年第70号)

05
关于发布《儿童用药(化学药品)药学开发指导原则(试行)》的通告(2020年第67号)

06
关于发布《抗肿瘤创新药上市申请安全性总结资料准备技术指导原则》的通告(2020年第56号)

07
关于发布《化学药品改良型新药临床试验技术指导原则》的通告(2020年第54号)

08
关于发布《药物临床试验多重性问题指导原则(试行)》的通告(2020年第66号)

09
关于发布《药物临床试验协变量校正指导原则》的通告(2020年第65号)

10
关于发布《药物临床试验亚组分析指导原则(试行)》的通告(2020年第64号)

11
关于发布《群体药代动力学研究技术指导原则》的通告(2020年第63号)

12
关于发布《窄治疗指数药物生物等效性研究技术指导原则》的通告(2020年第62号)
13
关于发布《抗肿瘤药物临床试验统计学设计指导原则(试行)》的通告(2020年第61号)

14

15
关于发布《模型引导的药物研发技术指导原则》的通告(2020年第59号)

16
关于发布《抗肿瘤药联合治疗临床试验技术指导原则》的通告(2020年第55号)

17
关于发布《中药新药用于慢性便秘临床研究技术指导原则》《中药新药用于糖尿病肾脏疾病临床研究技术指导原则》的通告(2020年第57号)

18
关于开通使用国家药监局网上办事大厅统一登录入口的通知

19
关于发布《药品审评审批信息公开管理办法》的通告(2020年第58号)

NMPA
01
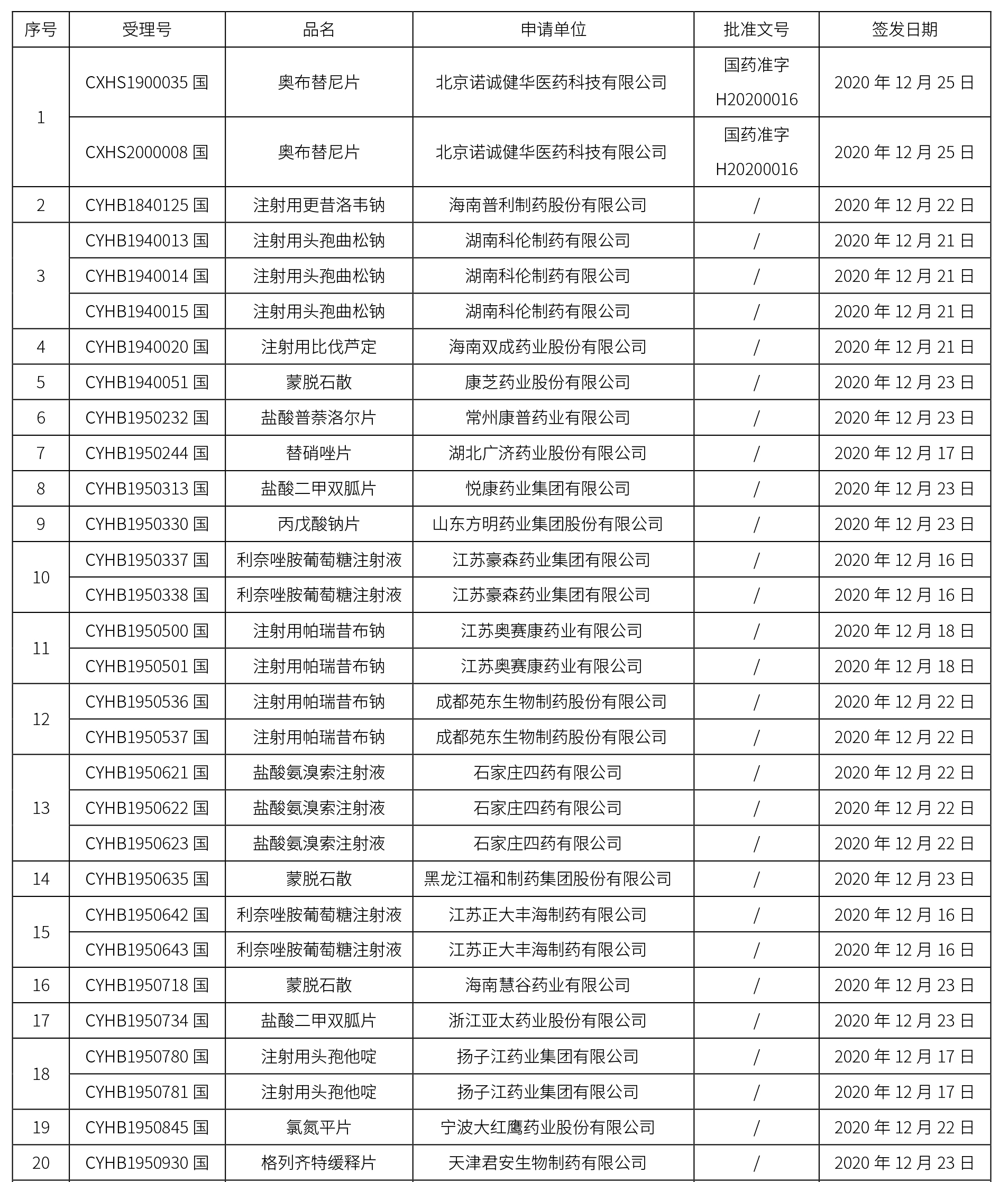
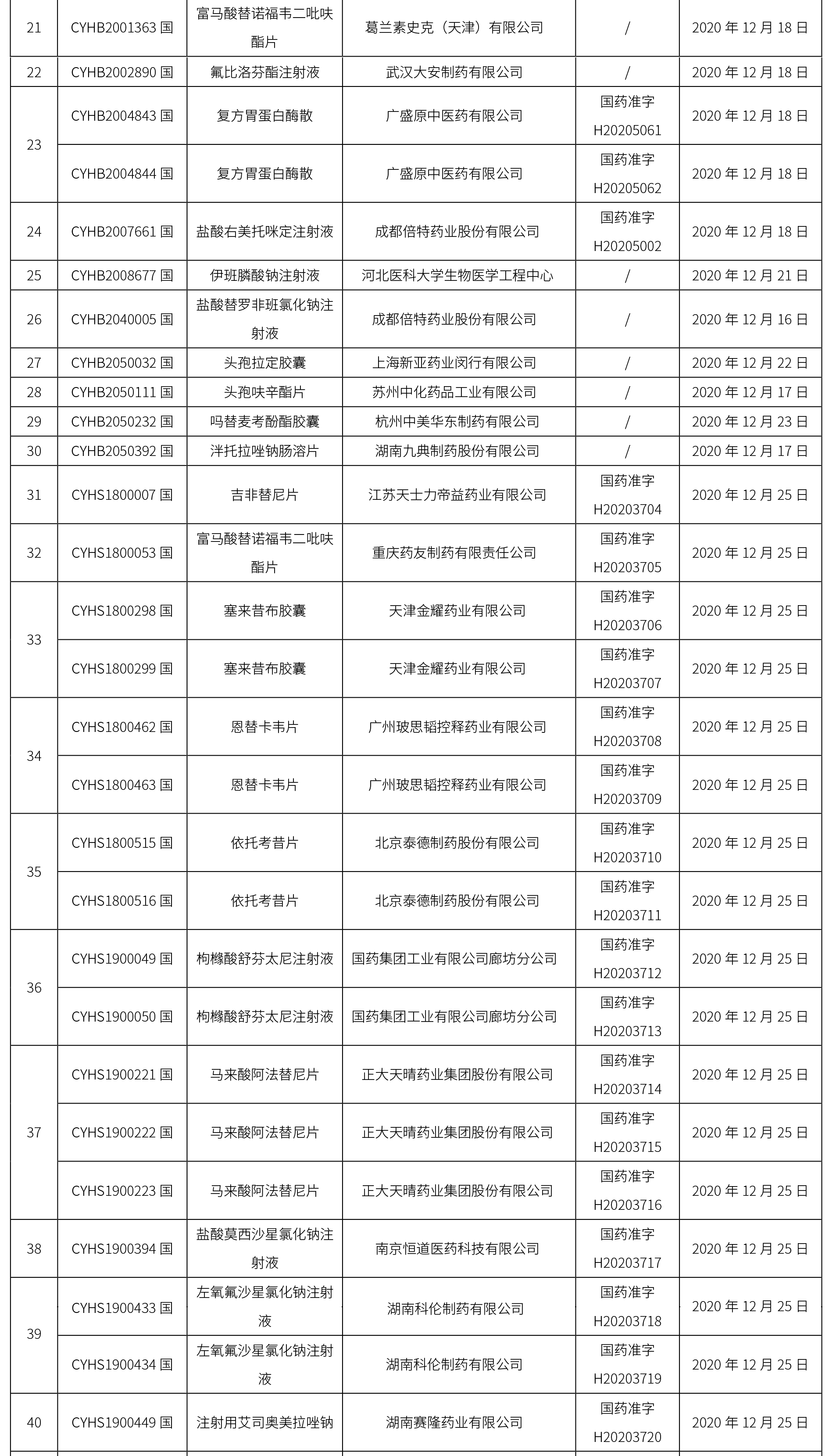
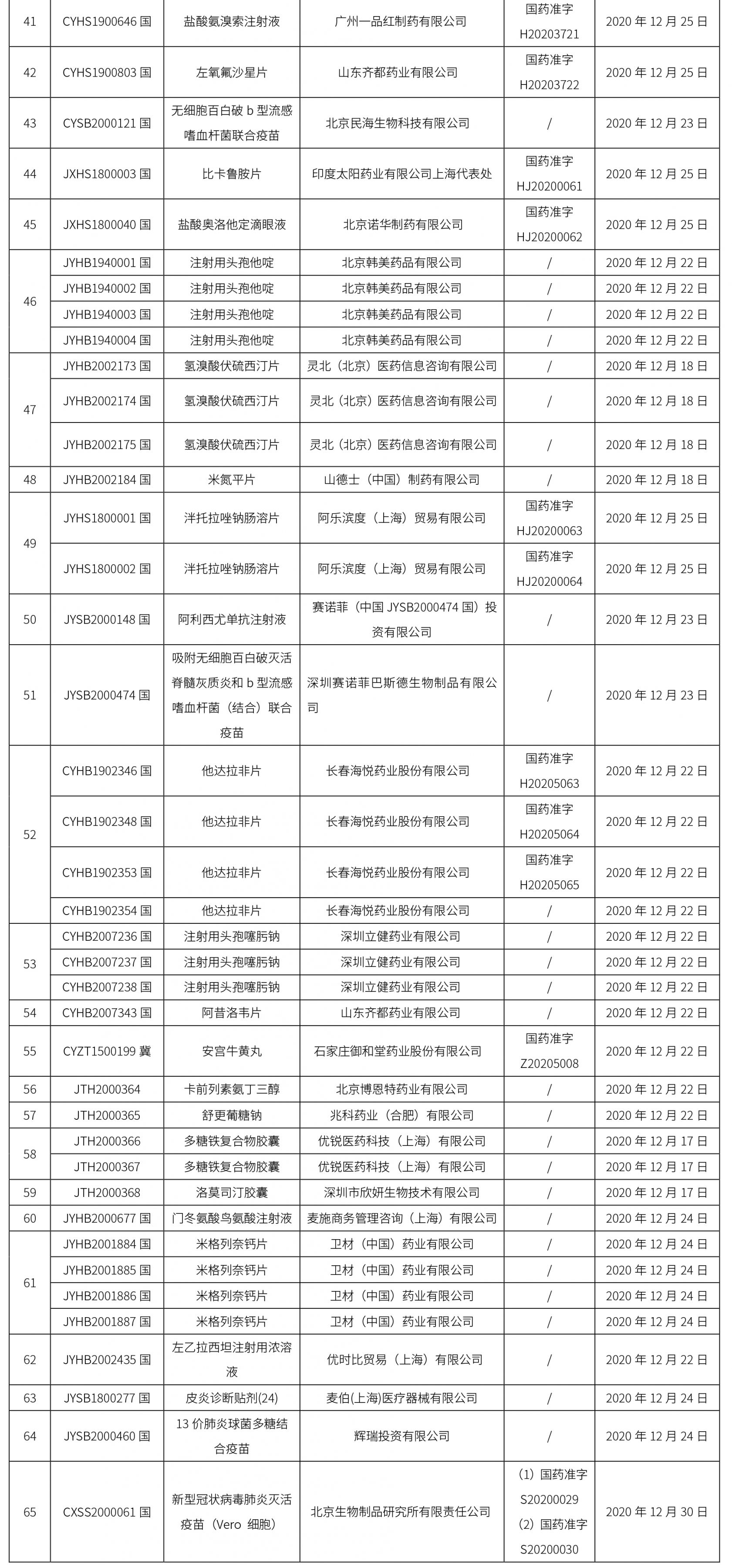
本周共计65个品种获批取得药品批准证明文件,其中一致性评价品种20个,包括注射剂品种7个,其中注射用更昔洛韦钠为首家过评品种。
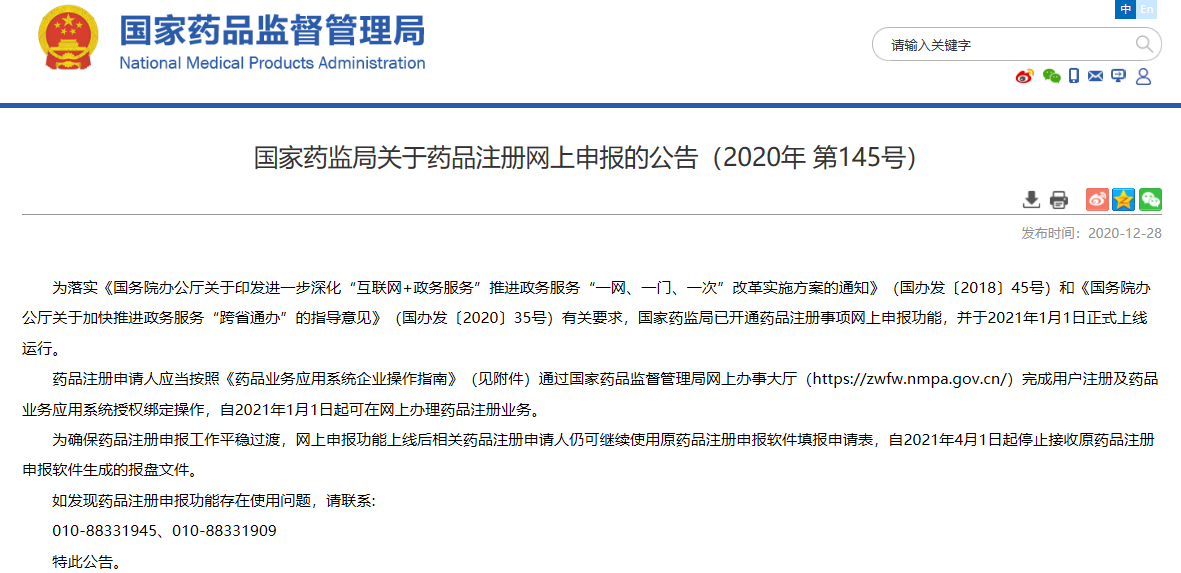
02
关于药品注册网上申报的公告(2020年 第145号)
为落实《国务院办公厅关于印发进一步深化“互联网+政务服务”推进政务服务“一网、一门、一次”改革实施方案的通知》(国办发〔2018〕45号)和《国务院办公厅关于加快推进政务服务“跨省通办”的指导意见》(国办发〔2020〕35号)有关要求,国家药监局已开通药品注册事项网上申报功能,并于2021年1月1日正式上线运行。
扫描下方二维码
查看具体法规内容

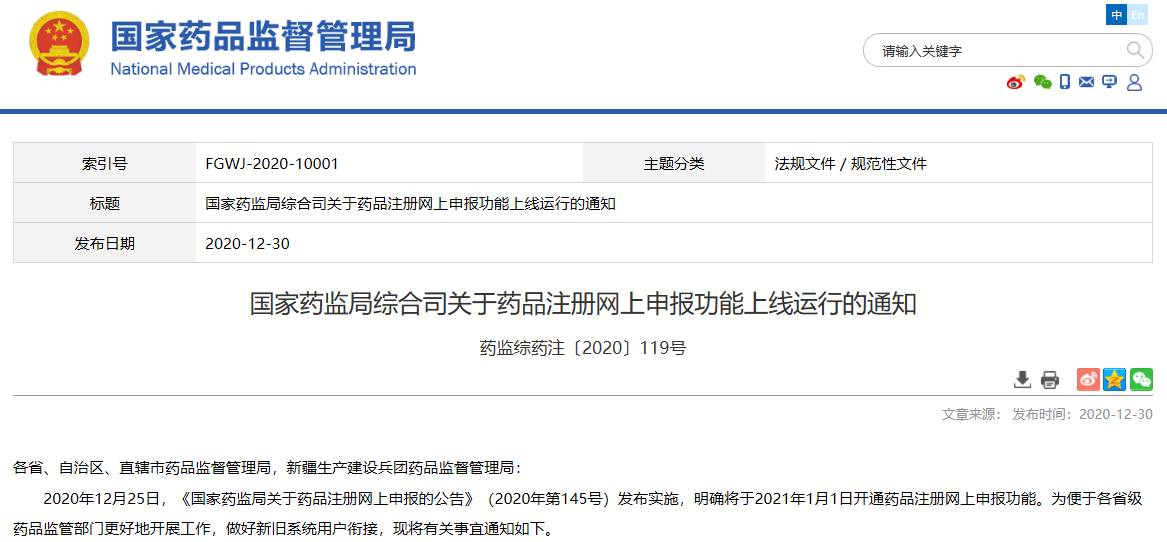
03
关于药品注册网上申报功能上线运行的通知
扫描下方二维码
查看具体法规内容

04
关于注销诺氟沙星胶囊等207个药品注册证书的公告(2020年第142号)

查看具体法规内容

05
关于发布仿制药参比制剂目录(第三十五批)的通告(2020年第92号)

扫描下方二维码
查看具体法规内容

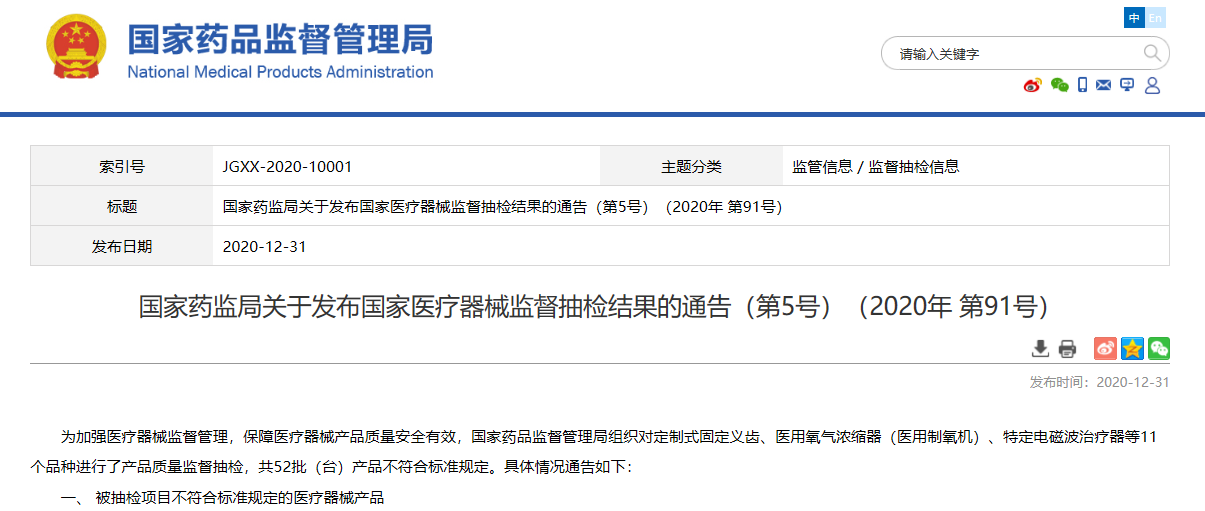
06
关于发布国家医疗器械监督抽检结果的通告(第5号)(2020年 第91号)
国家药品监督管理局组织对定制式固定义齿、医用氧气浓缩器(医用制氧机)、特定电磁波治疗器等11个品种进行了产品质量监督抽检,共52批(台)产品不符合标准规定。
扫描下方二维码
查看具体法规内容

CFDI
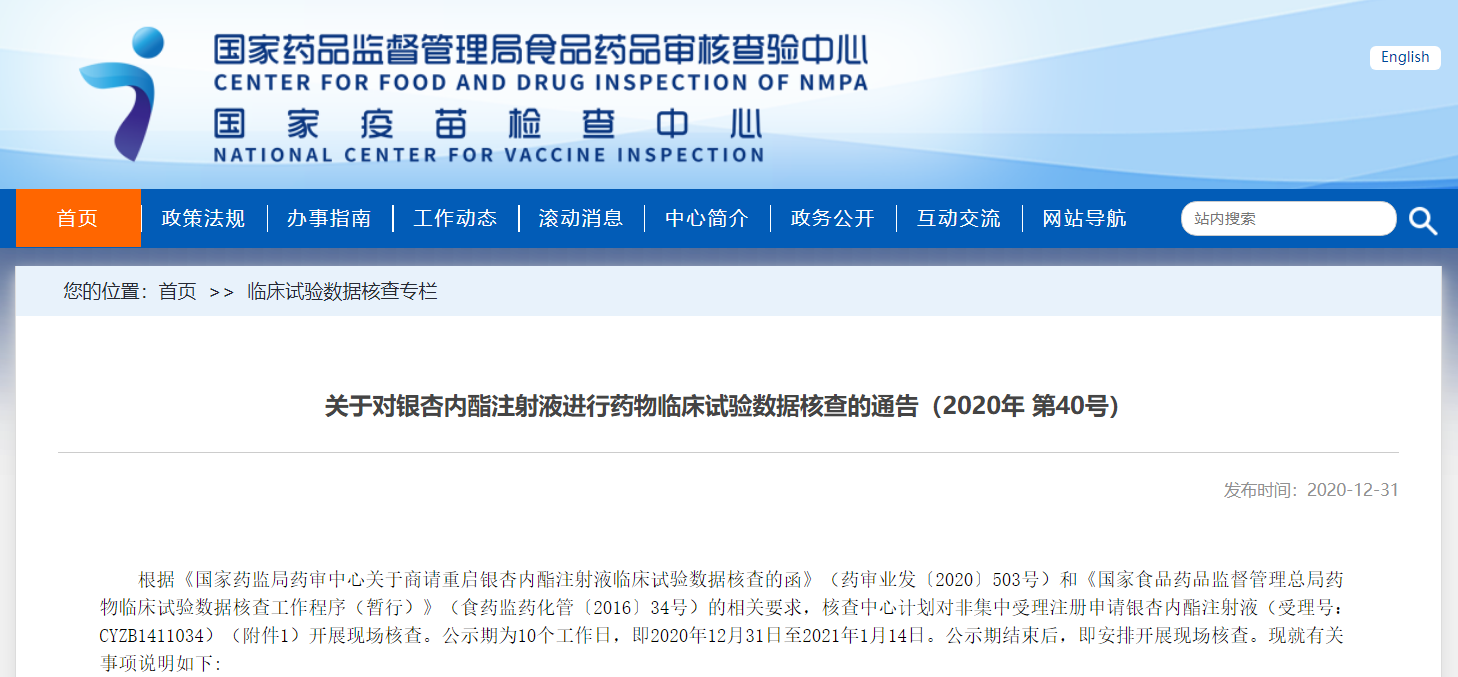
关于对银杏内酯注射液进行药物临床试验数据核查的通告(2020年 第40号)
扫描下方二维码
查看具体法规内容

药典委
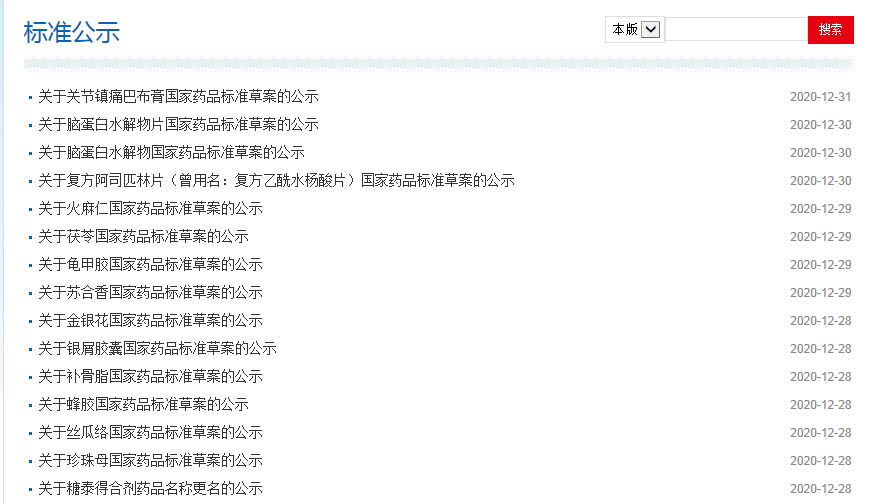
本周健脾止泻宁颗粒、银屑胶囊、火麻仁、关节镇痛巴布膏等国家药品标准公示如下:
扫描下方二维码
查看具体法规内容

-END-
关于我们:
药政部是隶属于公司副总裁直接领导下的部门,以国家药品政策为导向,以为客户提供集药物研发、注册申报、现场核查等一体化专业技术服务为宗旨,以高效、成功申报项目最终目标。
药政部拥有一支技术与注册经验丰富的团队,作为一家提供专业服务的公司,在原料药登记、仿制药一致性评价、仿制药注册、新药注册以及进口药品注册等方面均具有专业且丰富的经验,已助力成功申报多项药品注册申请,在业内具有良好的口碑。
部门坚持 “忠诚、思考、建设、承担、分享”的公司理念,不断加强人才队伍建设、提升专业能力、丰富注册经验、拓展业务范围,致力于为客户提供高效率、高质量、合规的技术服务,为保护和促进公众健康而不懈努力。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450