政策法规||本周重磅政策法规概览(20.11.30-12.04)
NMPA/CDE/CFDI/药典委公布药品/医疗器械相关内容本周集锦。
NMPA
01
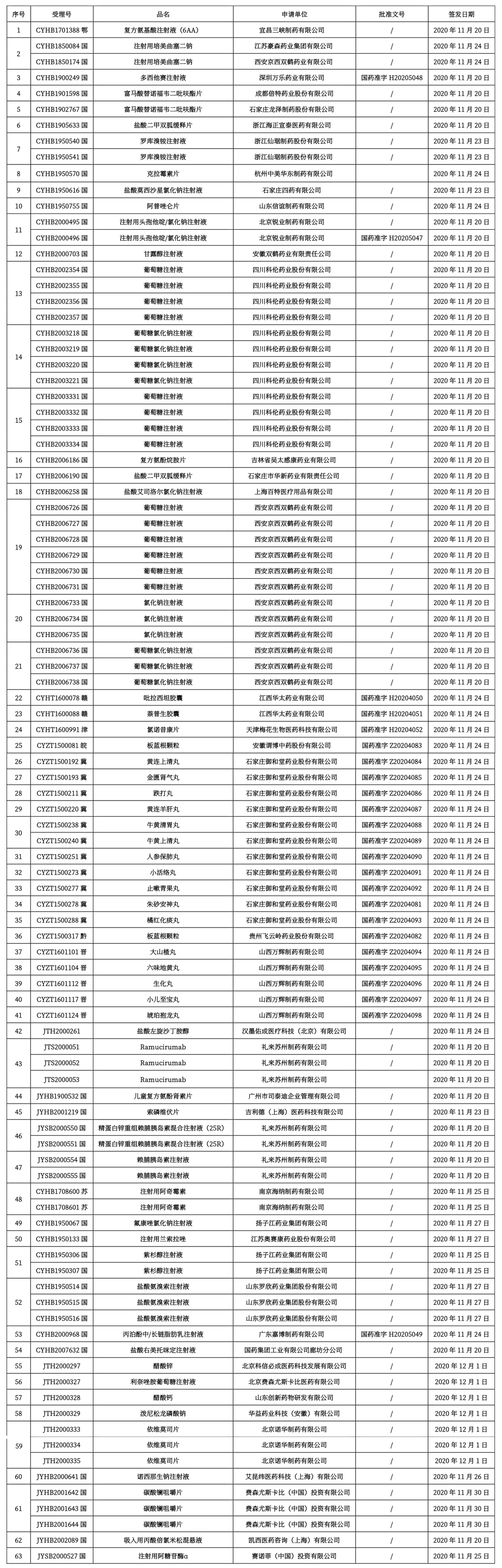
本周共计63个品种获批取得药品批准证明文件,其中一致性评价品种9个。
02
《药物警戒质量管理规范(征求意见稿)》
规范药品上市许可持有人药物警戒主体责任,国家药品监督管理局起草了《药物警戒质量管理规范(征求意见稿)》,.适用于药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告与处理等,现向社会公开征求意见,时间截止至2020.12.28。
长按识别图中二维码
查看详细信息

03
关于发布小败毒膏中莨菪碱类生物碱检查项补充检验方法的公告(2020年 第129号)
长按识别图中二维码
查看详细信息

04
药品注册申请药学研制和生产现场核查任务信息公告(2020年第19号)、(2020年第20号),共计57个品种。
长按识别图中二维码
查看详细信息

长按识别图中二维码
查看详细信息

CDE
01
发布《单臂试验支持上市的抗肿瘤药进入关键试验前临床方面沟通交流技术指导原则》的通告(2020年第47号)

长按识别图中二维码
查看详细信息

《单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则》的通告(2020年第46号)

长按识别图中二维码
查看详细信息

上述技术指导原则自2020.12.2起执行。
02
关于发布《晚期肝细胞癌临床试验终点技术指导原则》的通告(2020年第44号)
长按识别图中二维码
查看详细信息

03
关于发布《GnRH激动剂用于晚期前列腺癌临床试验设计指导原则》的通告(2020年第45号)

长按识别图中二维码
查看详细信息

关于公开征求ICH《Q7:原料药的药品生产质量管理规范指南》中文翻译稿意见的通知
为推动ICH指导原则在我国医药行业的转化实施,国家核查中心组织翻译了ICH《Q7:原料药的药品生产质量管理规范指南》,现将中文翻译稿公开并征求意见,时间截止至2020.12.18。
长按识别图中二维码
查看详细信息

关于公开征求《药品生产场地管理文件指南(试行)》意见的通知
为落实《药品生产监督管理办法》(国家市场监督管理总局令第28号)有关药品生产场地管理的规定,明确场地管理文件的内容、格式及管理要求,根据国家局的布署,核查中心组织起草了《药品生产场地管理文件指南(试行)》。现将该指南公开并征求意见,时间截止至2020.12.18。
长按识别图中二维码
查看详细信息

本周益心颗粒、胃苏泡腾片、胰胆舒颗粒、咳嗽宁片、益气复脉颗粒国家药品标准草案公示。
长按识别图中二维码
查看详细信息

-END-
关于我们:
综合信息部由20名成员组成,其中总监1名、经理2名、主管1名、高级药理专员1名、药理专员15名,均来自北京大学、中国医学科学院北京协和医学院等国内外知名院校。综合信息部主要负责公司的国际/国内项目立项、品种市场信息支持、公司知识产权维护及撰写临床/药理相关申报材料,为公司研发提供信息保障。
部门下设5个中心,其中仿创药立项策略中心主要负责仿制药、创新药品种立项;临床&药理中心负责相关申报材料撰写;知识产权中心负责公司知识产权维护;大数据分析中心负责国内外品种信息分析、企业产品管线规划及战略合作伙伴个性化信息支持;国际新产品策略中心关注国际原料药、装置、制剂品种信息,提供中美、中欧双报立项信息。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450