政策法规||本周重磅政策法规概览(20.11.09-11.13)
CDE/NMPA/药典委公布药品相关内容本周集锦。
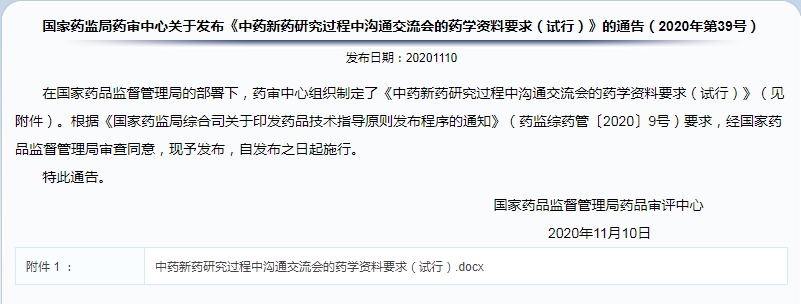
《中药新药研究过程中沟通交流会的药学资料要求(试行)》的通告(2020年第39号)
要求针对药物临床试验申请前、药物Ⅱ期临床试验结束/Ⅲ期临床试验启动前、药物Ⅱ期临床试验结束/Ⅲ期临床试验启动前、药品上市许可申请前沟通交流会用资料,主要内容如下:
✎ 药物研究概况。重点说明现有研究数据是否支持下一步研究或风险可控。
✎ 药学研究资料。提供完整的申请药物临床试验研究资料,特别是注意围绕拟讨论问题提供相关资料。
✎ 拟讨论问题。分条目列出拟讨论药学问题清单。针对问题分别提供相关资料,包括相应的研发背景、详实的研究数据(和/或文献资料)及初步解决方案等。
扫描图中二维码
查看详细文件

01
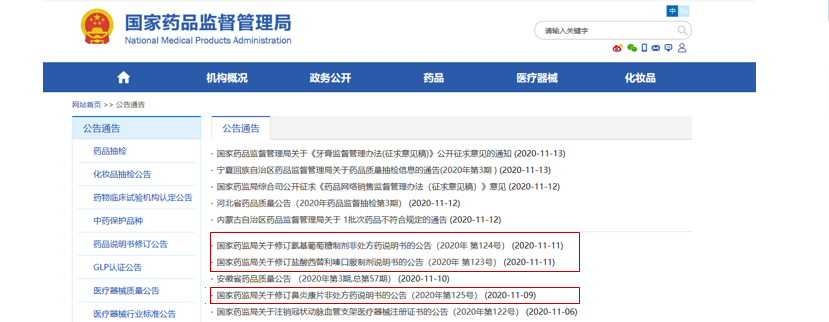
关于盐酸西替利嗪口服制剂、氨基葡萄糖制剂非处方药、鼻炎康片非处方药说明书的修订公告。
扫描图中二维码
查看详细文件

02
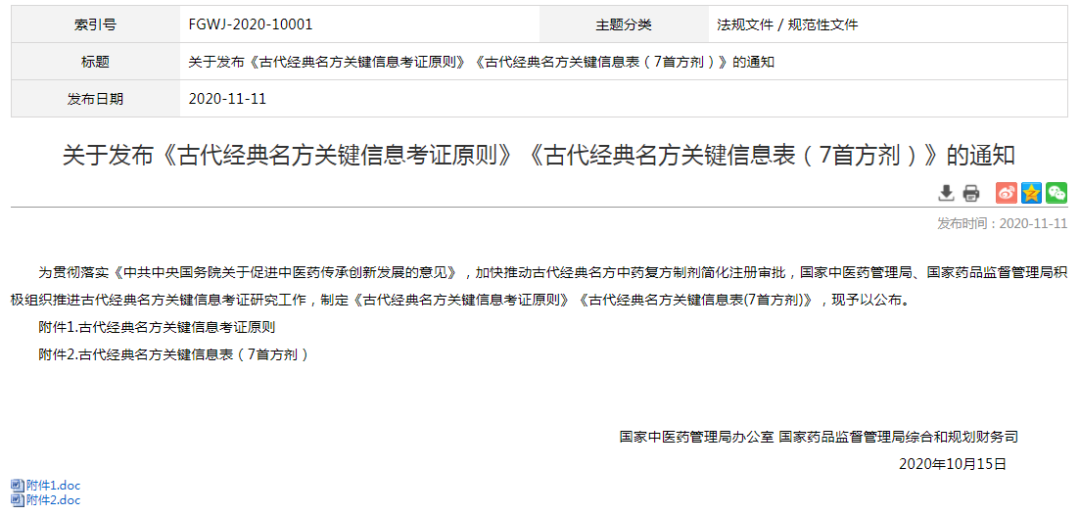
关于《古代经典名方关键信息考证原则》《古代经典名方关键信息表(7首方剂)》的发布。
扫描图中二维码
查看详细文件

关于乳泰胶囊、奥沙拉秦钠、氨酚伪麻那敏咀嚼片、氨酚帕马溴片、氨酚伪麻那敏胶囊国家药品标准草案公示。

扫描图中二维码
查看详细文件

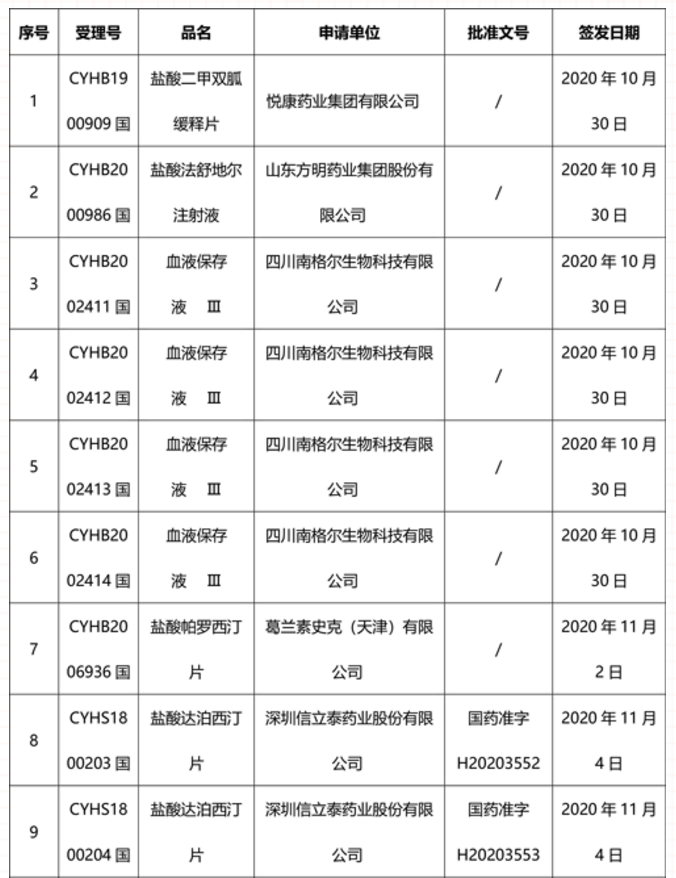
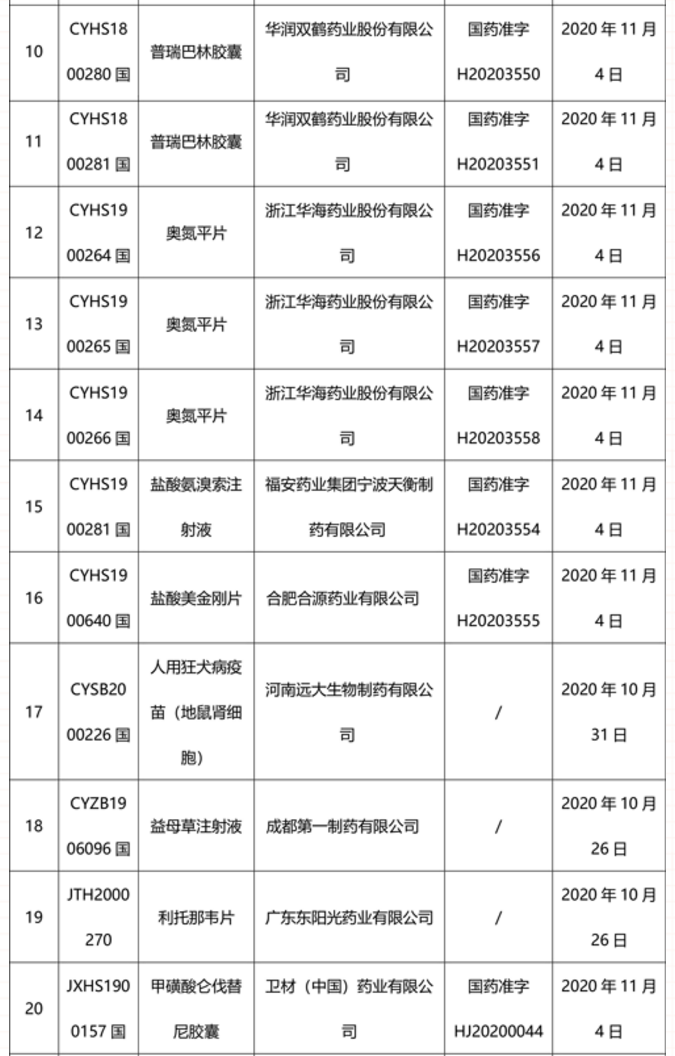
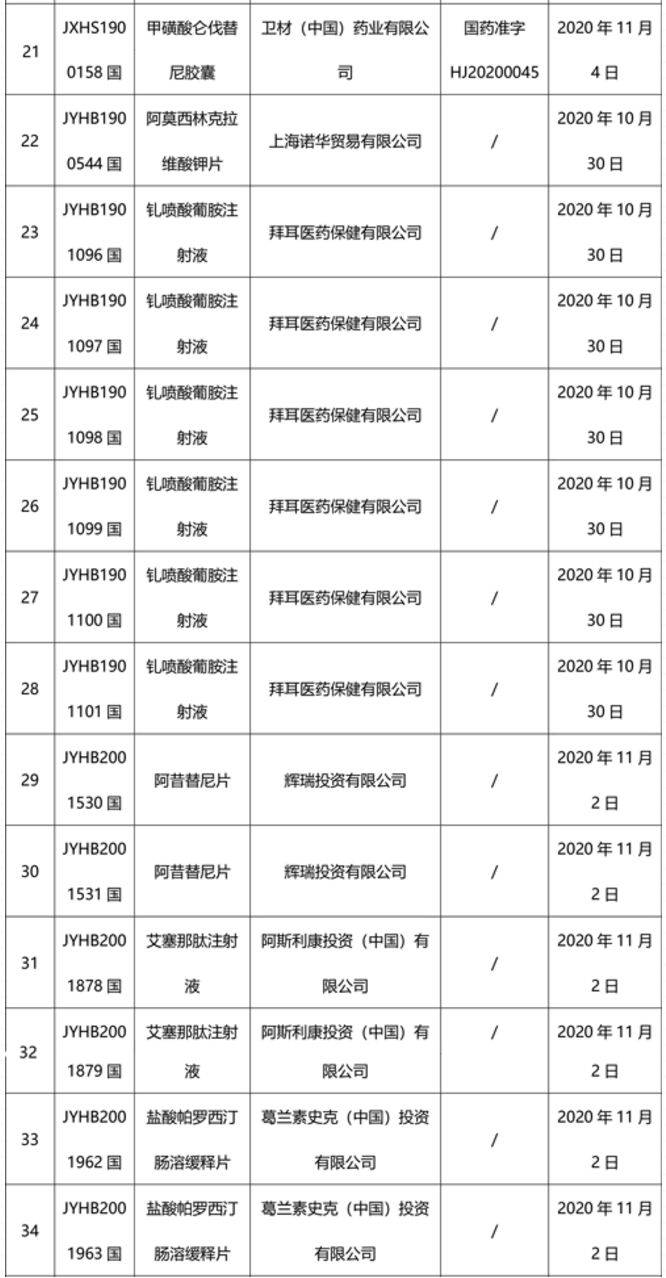
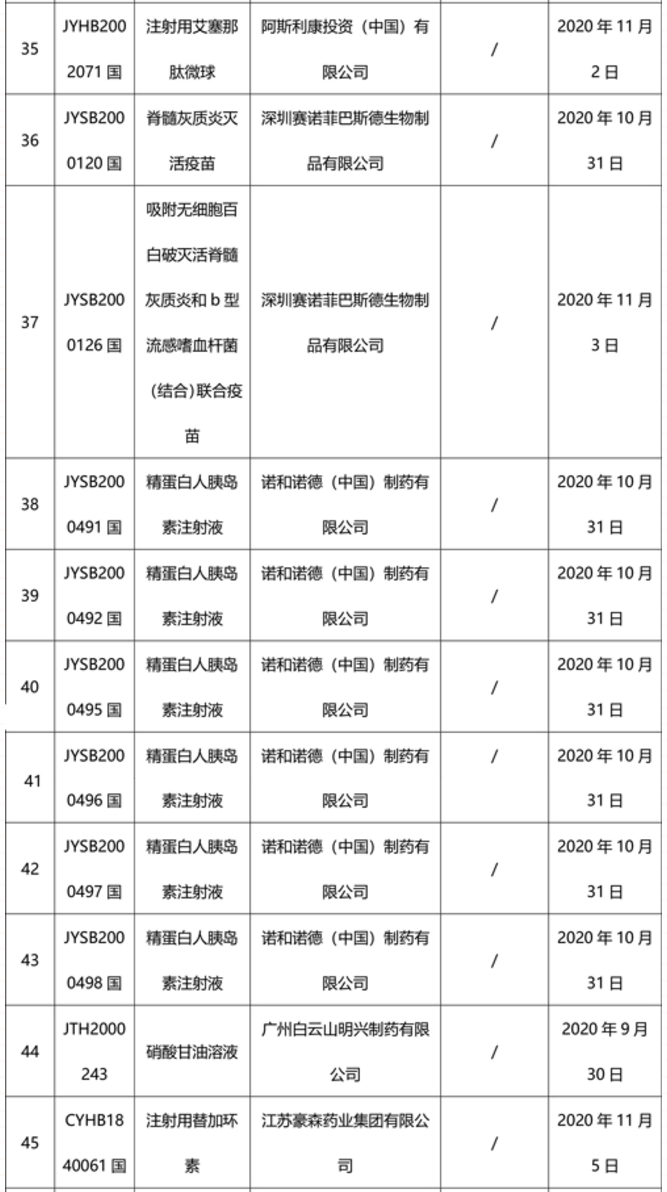
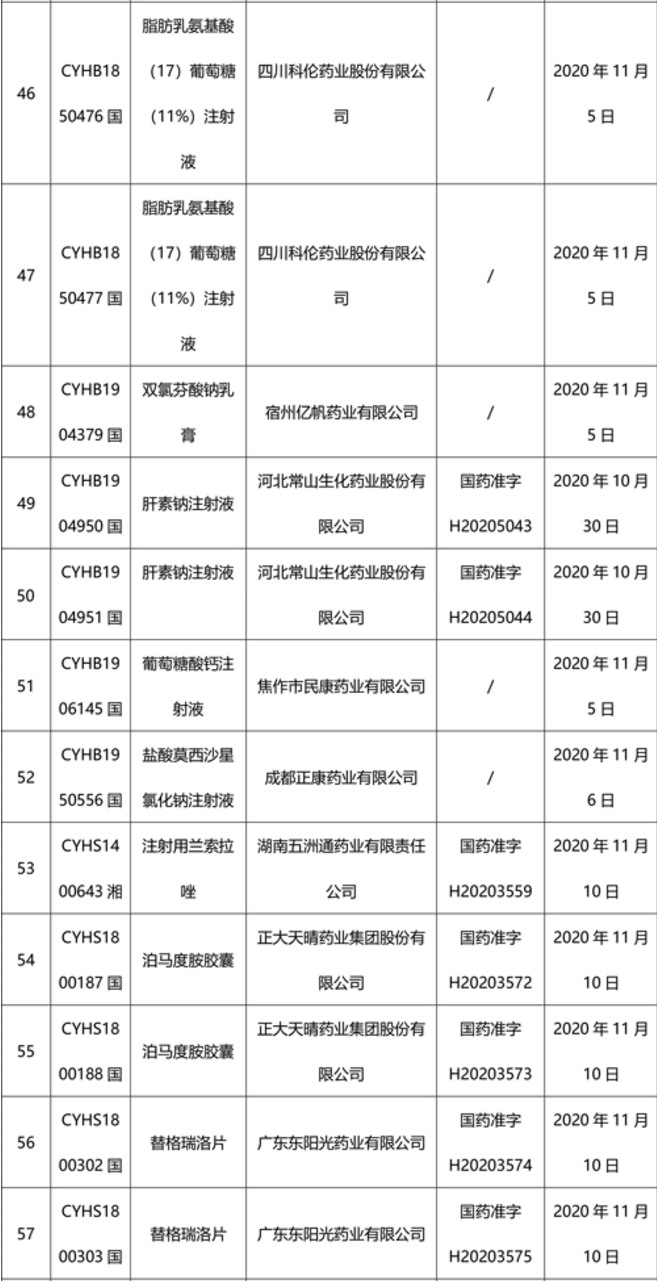
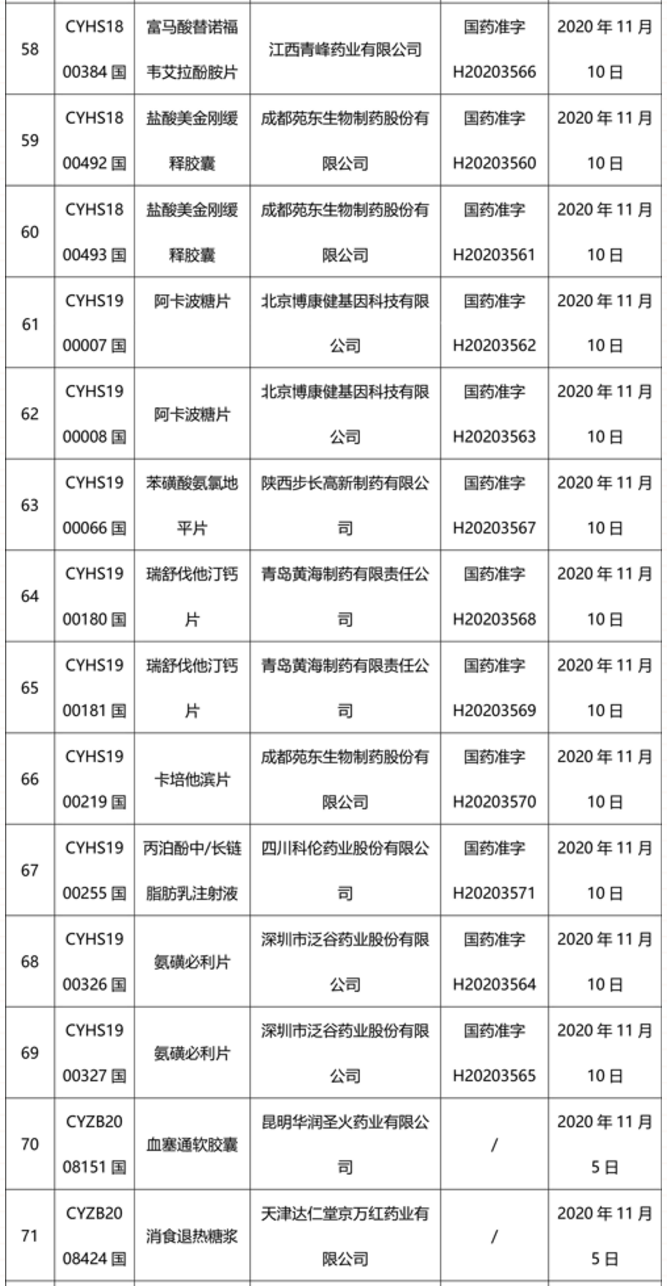
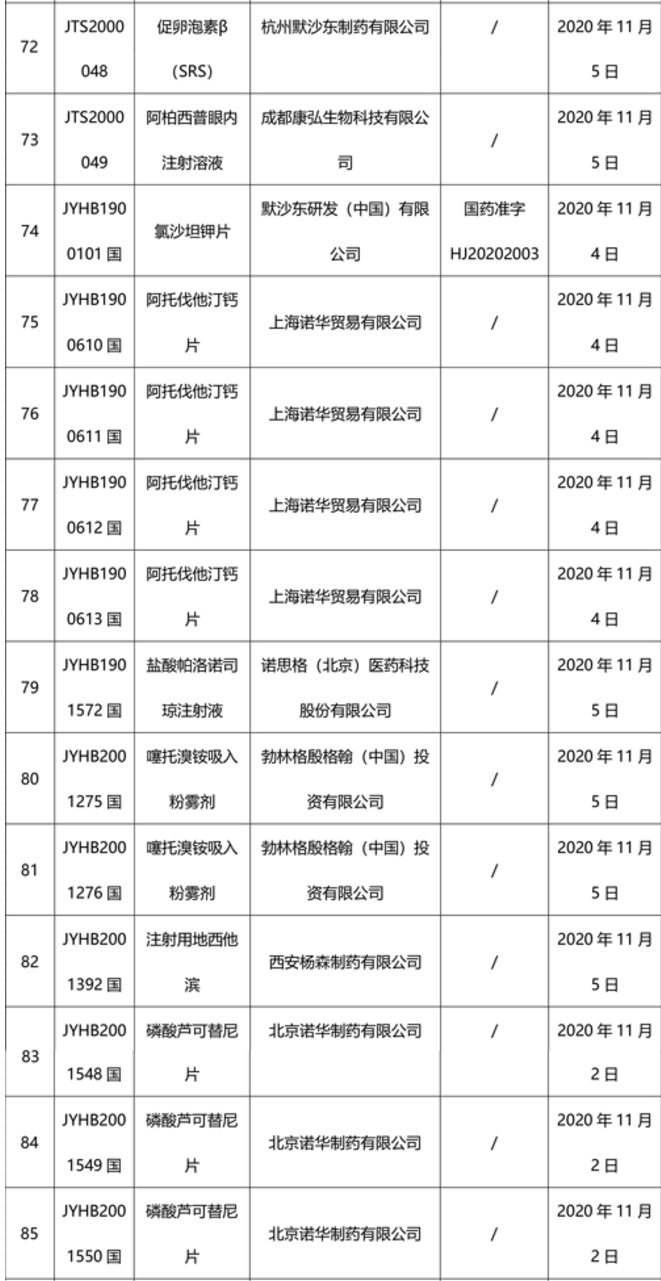
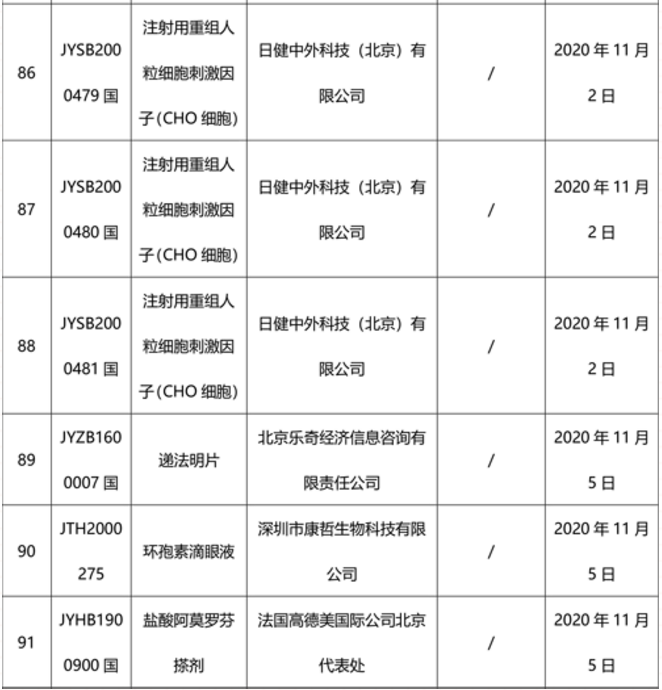
本周91个药品批准证明文件待领取
-END-
关于我们:
药政部是隶属于公司副总裁直接领导下的部门,以国家药品政策为导向,以为客户提供集药物研发、注册申报、现场核查等一体化专业技术服务为宗旨,以高效、成功申报项目最终目标。
药政部拥有一支技术与注册经验丰富的团队,作为一家提供专业服务的公司,在原料药登记、仿制药一致性评价、仿制药注册、新药注册以及进口药品注册等方面均具有专业且丰富的经验,已助力成功申报多项药品注册申请,在业内具有良好的口碑。
部门坚持 “忠诚、思考、建设、承担、分享”的公司理念,不断加强人才队伍建设、提升专业能力、丰富注册经验、拓展业务范围,致力于为客户提供高效率、高质量、合规的技术服务,为保护和促进公众健康而不懈努力。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450