政策法规||本周重磅政策法规概览(21.02.22-21.02.26)
01
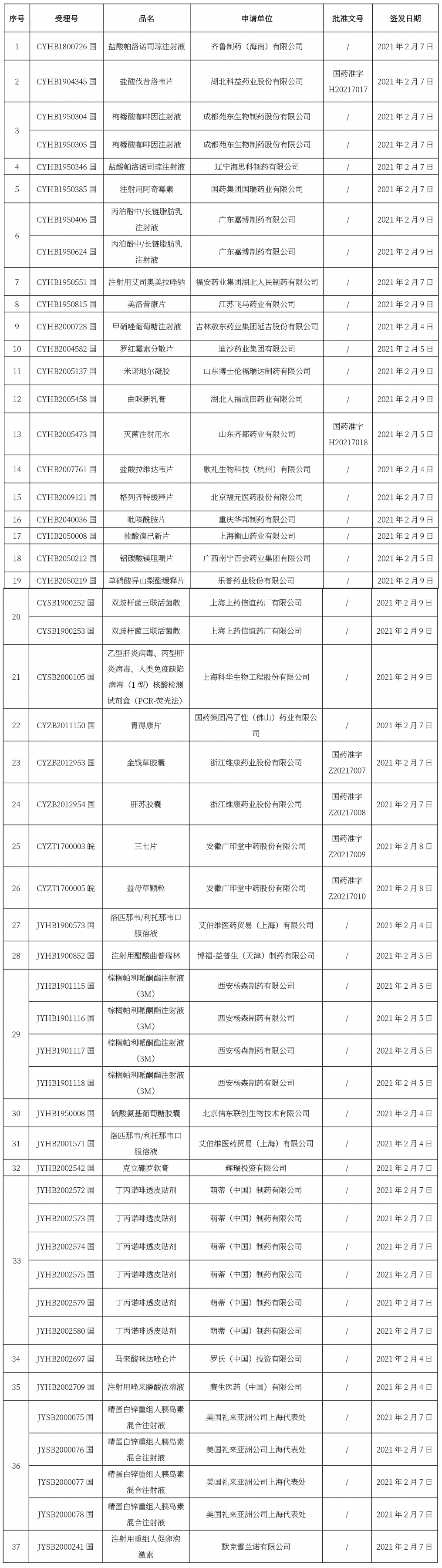
本周共计37个品种获批取得药品批准证明文件,其中一致性评价品种10个,包括注射剂品种6个。
关于发布《已上市中药变更事项及申报资料要求》的通告(2021年第19号)
扫描图中二维码
查看详细信息

关于发布仿制药参比制剂目录(第三十八批)的通告(2021年 第18号)

扫描图中二维码
查看详细信息

04
关于2020年检验能力验证计划满意结果的通报
扫描图中二维码
查看详细信息

关于发布《药审中心技术审评报告公开工作规范(试行)》的通告(2021年第19号)

扫描图中二维码
查看详细信息

02
关于公开征求《基因修饰细胞治疗产品非临床研究与评价技术指导原则》(试行)意见的通知

扫描图中二维码
查看详细信息

03
关于发布《放射性体内诊断药物非临床研究技术指导原则》的通告(2021年第20号)

扫描图中二维码
查看详细信息

04
关于ICH Q5D、M9及M9问答实施建议公开征求意见的通知

扫描图中二维码
查看详细信息

药品注册申请人在线确认“待核查品种信息”常见问题解答(三)
Q1
新注册办法实施前申报的原料药品种,目前尚未完成工艺验证,注册现场核查前在填写申请表时,是否可以另附说明,承诺在一定时限内完成工艺验证,然后安排核查?
答:不可以的。商业规模的工艺验证是说明注册申请的药品在预定工艺参数范围内运行的生产工艺可以持续有效地生产出符合预定质量产品的重要证据,无论新注册管理办法实施之前还是之后受理的品种,在提交注册核查申请表或确认表之前,必须完成商业规模的工艺验证。
Q2
我司产品即将接受注册现场核查,CDE发补时对一些生产参数的提出了收紧的要求,我司在制造检定规程中已经修改并提交至CDE,但是目前阶段上述参数是否得到CDE的认可,后续是否还会有修改,我们还不确定,所以在制检规程中上述参数并未更新,注册现场核查时,我司是否需要将工艺规程中的参数更新,与提交给CDE的制造工艺规程参数一致?
答:确实存在您所描述的情形。因目前需要申请人提交的确认表,包括3个附件,其中关键生产批次的变更情况可以在表3即《关键批次与申报资料变化情况汇总表》中予以说明。
Q3
联合核查情况下,CFDI是否规定各环节的时限,特别是核查结束后,省局审核报告完成并报送CFDI的时限,经常有超过1个月还未寄到CFDI?
答:鉴于疫情的不可预见性,目前没有专门规定各省联合核查任务完成的具体时限。从2020年联合核查任务完成情况数据统计来看:检查组完成现场核查后,检查组报告和省局审核意见报告返回CFDI的平均时间约30天(日历日),对于需要省局确认核查发现缺陷整改落实情况的,在对企业的整改报告审核后省局才能出具审核意见,返回CFDI的时间会加长。企业整改时间会影响省局审核意见的时间,CFDI有专人就联合核查的情况同各省局保持沟通交流,发现异常情形会督促省局加快办理。
Q4
核查任务的管理时限是工作日还是日历日?
答:是工作日。
Q5
注册核查企业能否申请延迟核查?
答:申请人在规定的时限内可以申请延迟核查。根据目前注册核查工作程序,除了自然灾害、政府行为等不可抗力的正当理由外,申请人未在规定的时限内进行生产现场核查确认,或不能在规定的时限内接受现场核查的,核查中心可以终止相关核查任务,说明原因和依据后告知CDE。需要请大家关注的是,新版《药品注册管理办法》实施前后受理的药品注册申请,现场检查时限规定是有不同的。
药典委
本周珍黄胃片、强力定眩片、胃疡宁丸国家药品标准草案的公示;腰痛宁胶囊药典标准草案公示;培化磷脂酰乙醇胺、二硬脂酰磷脂酰胆碱、二硬脂酰磷脂酰甘油钠药用辅料标准草案的公示;盐酸替扎尼定、盐酸替扎尼定片国家药品标准修订草案的公示。
扫描图中二维码
查看详细信息

-END-
关于我们:
药政部是隶属于公司副总裁直接领导下的部门,以国家药品政策为导向,以为客户提供集药物研发、注册申报、现场核查等一体化专业技术服务为宗旨,以高效、成功申报项目最终目标。
药政部拥有一支技术与注册经验丰富的团队,作为一家提供专业服务的公司,在原料药登记、仿制药一致性评价、仿制药注册、新药注册以及进口药品注册等方面均具有专业且丰富的经验,已助力成功申报多项药品注册申请,在业内具有良好的口碑。
部门坚持 “忠诚、思考、建设、承担、分享”的公司理念,不断加强人才队伍建设、提升专业能力、丰富注册经验、拓展业务范围,致力于为客户提供高效率、高质量、合规的技术服务,为保护和促进公众健康而不懈努力。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450