政策法规||《药物临床试验期间方案变更技术指导原则(试行)》(附本周法规概览06.20-06.24)
国家药监局药审中心关于发布《药物临床试验期间方案变更技术指导原则(试行)》的通告(2022年第34号)
《指导原则》适用于与注册相关的中药、化药、生物制品(含疫苗)相关的临床试验方案变更,不适用于临床试验期间改变剂型、给药途径、新增适应症以及增加与其他药物联合用药等情形。
扫描下方二维码
查看详细内容

01
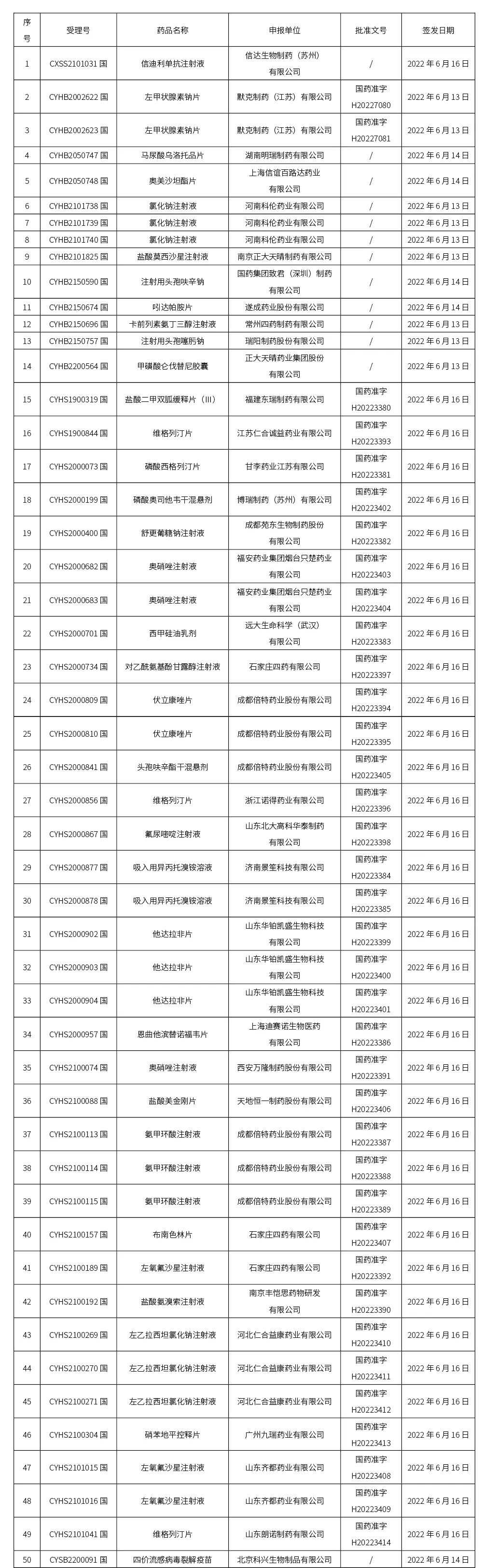
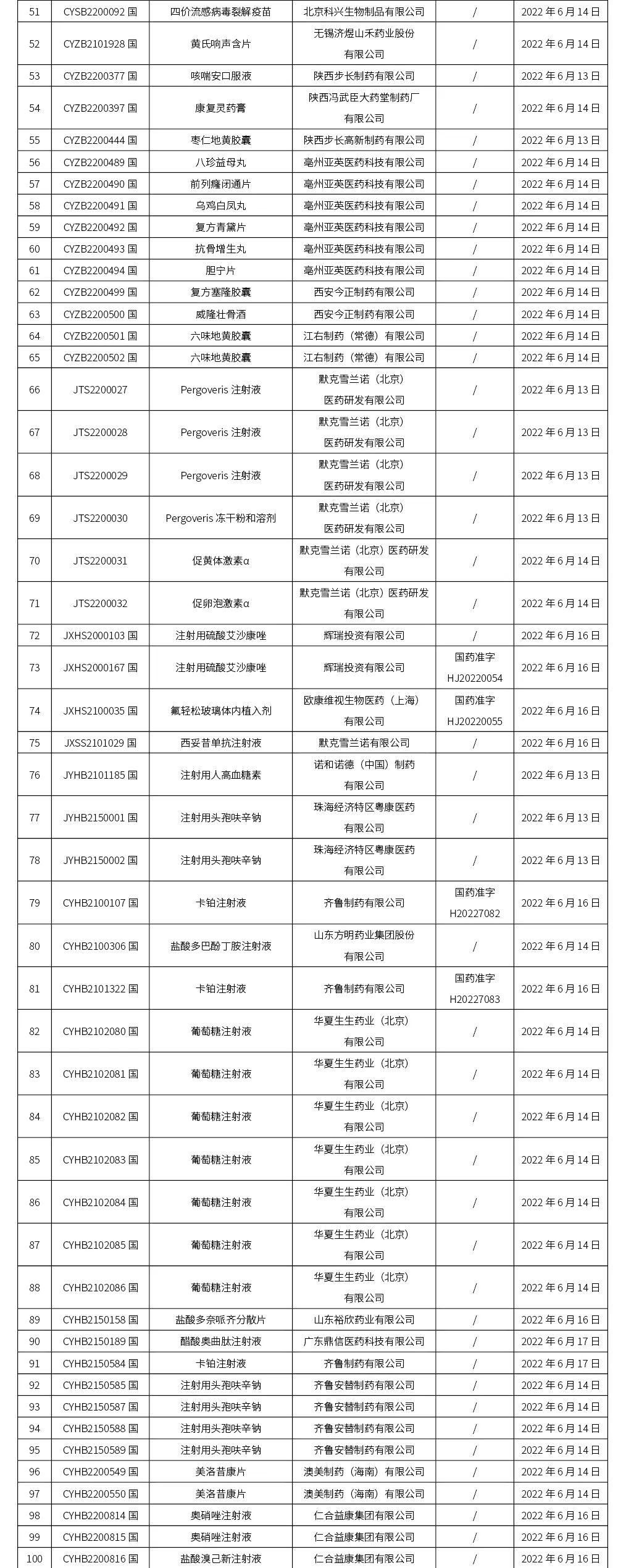
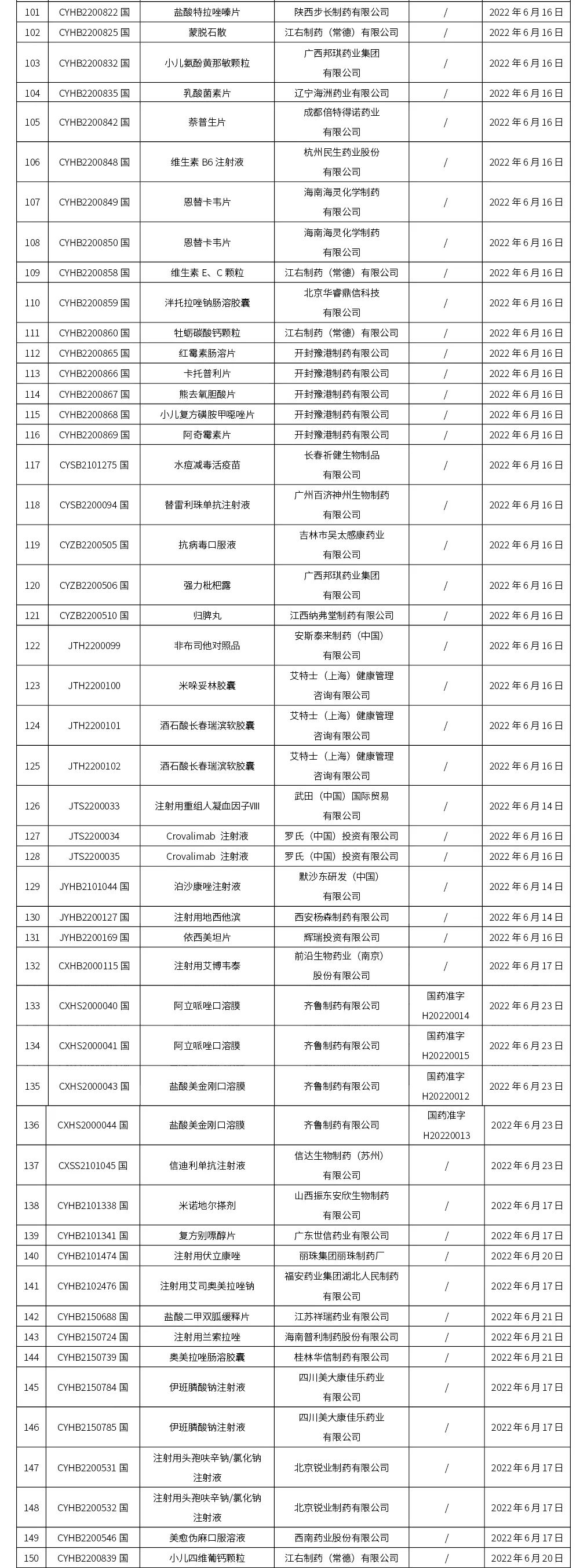
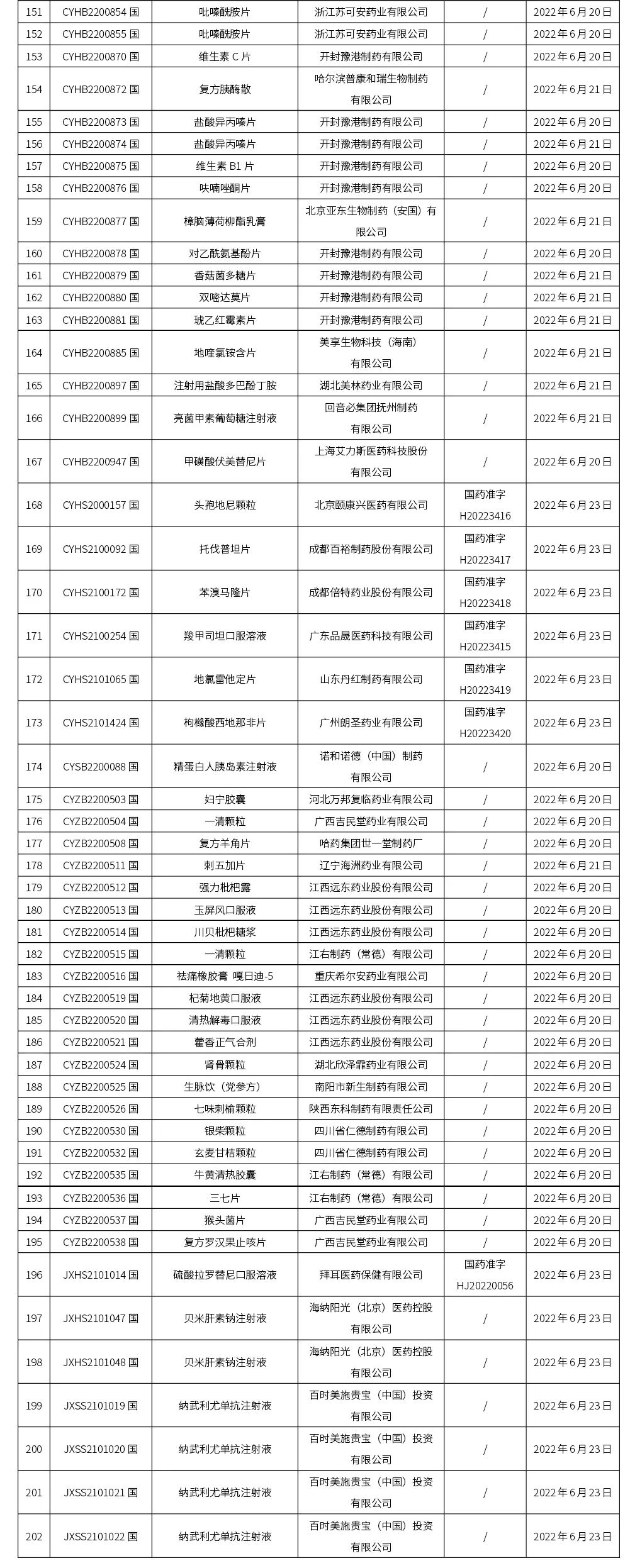
本周(截止到6.24下午4:38)共计202个品种取得药品批准证明文件,其中一致性评价品种18个。
02
国家药监局关于修订氨糖美辛制剂说明书的公告(2022年第49号)
扫描识别图中二维码
查看详细信息

01
国家药监局药审中心关于发布《药物临床试验期间方案变更技术指导原则(试行)》的通告(2022年第34号)
扫描识别图中二维码
查看详细信息

02
关于《他达拉非片生物等效性研究指导原则(征求意见稿)》等三项技术指导原则公开征求意见的通知
扫描识别图中二维码
查看详细信息

03
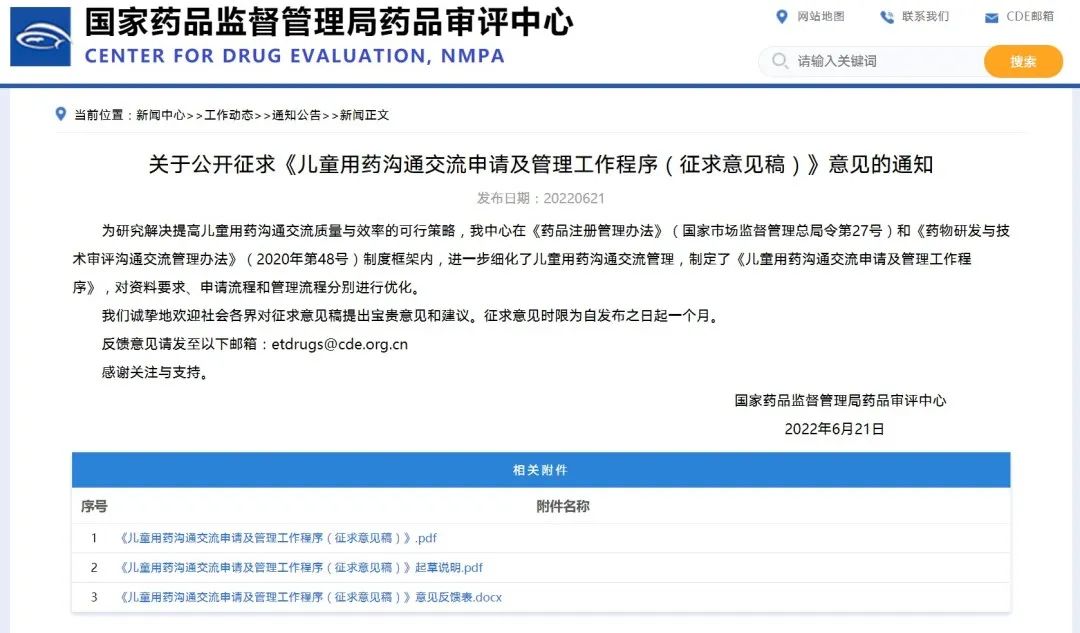
关于公开征求《儿童用药沟通交流申请及管理工作程序(征求意见稿)》意见的通知
扫描识别图中二维码
查看详细信息

04
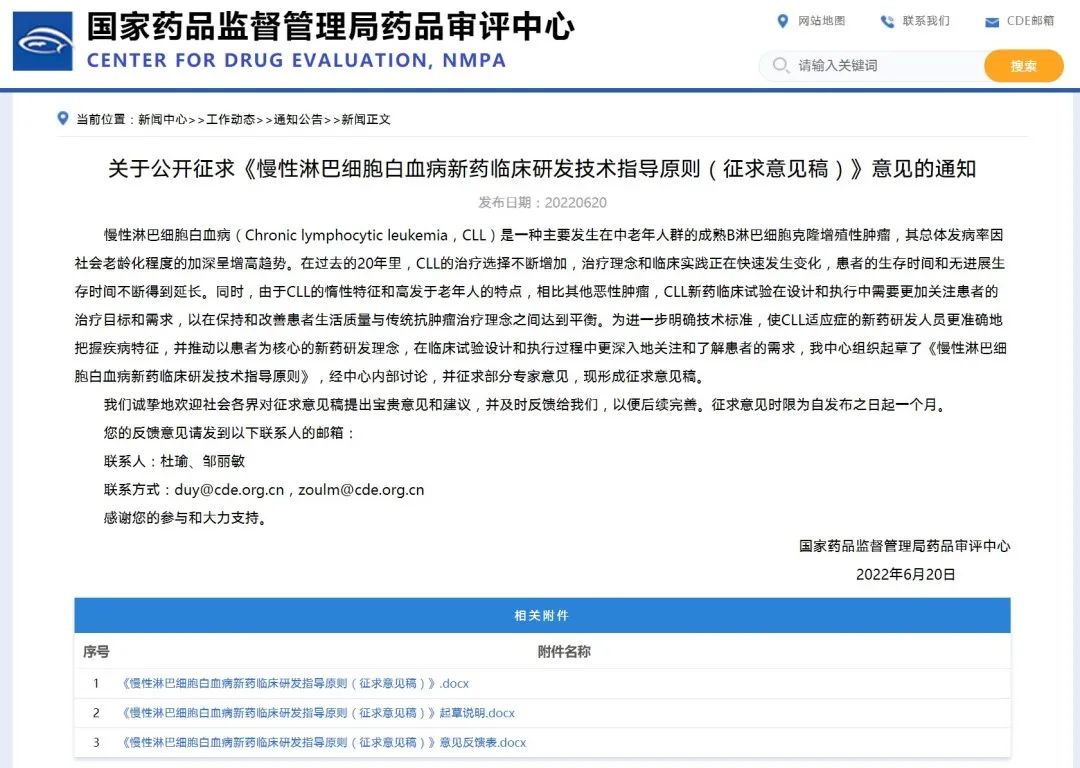
关于公开征求《慢性淋巴细胞白血病新药临床研发技术指导原则(征求意见稿)》意见的通知
扫描识别图中二维码
查看详细信息

05
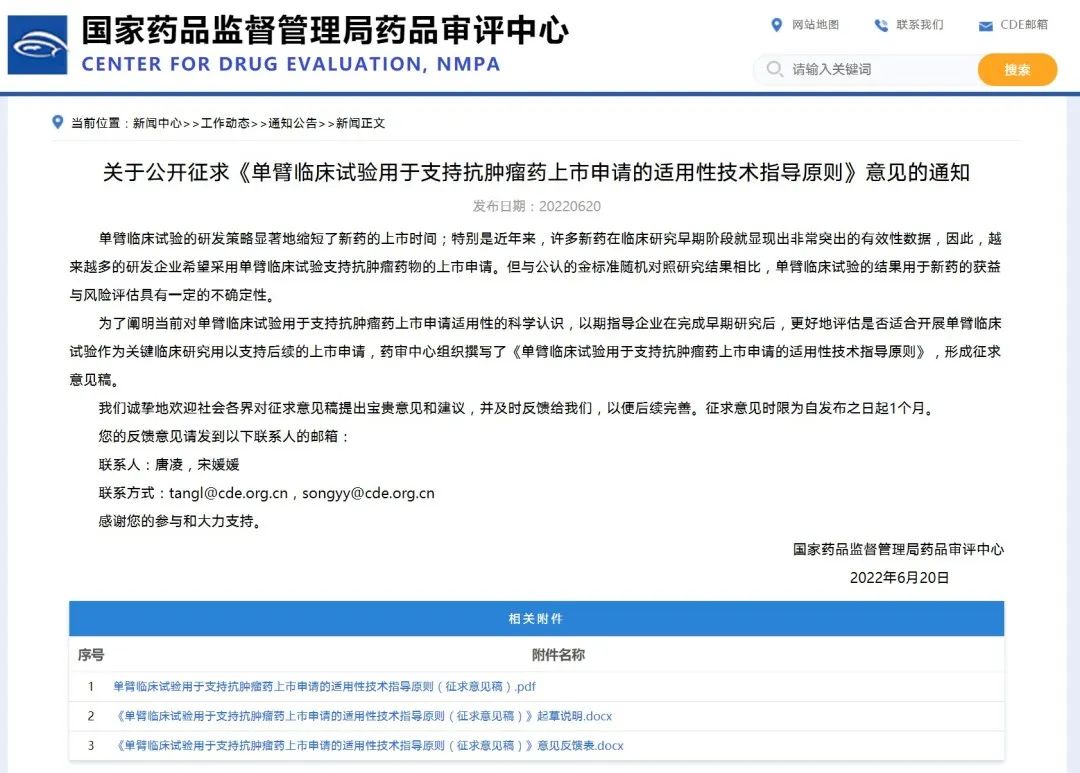
关于公开征求《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》意见的通知
扫描识别图中二维码
查看详细信息

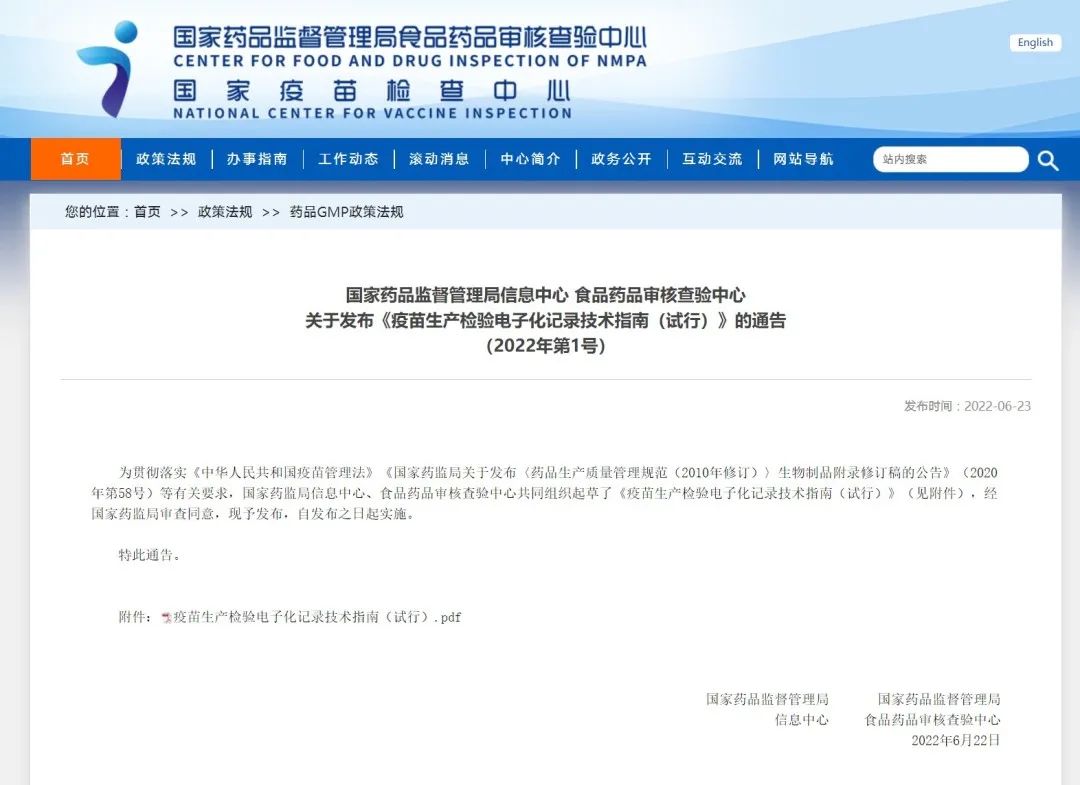
国家药品监督管理局信息中心食品药品审核查验中心关于发布《疫苗生产检验电子化记录技术指南(试行)》的通告
扫描识别图中二维码
查看详细信息

扫描识别图中二维码
查看详细信息

-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450