政策法规 ||《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(试行)》附法规概览03.20-03.24)
01
国家药监局药审中心关于发布《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(试行)》的通告(2023年第23号)

扫描识别图中二维码
查看详细信息

02
国家药监局药审中心关于发布《治疗卵巢癌新药临床研发技术指导原则(试行)》的通告(2023年第21号)

扫描识别图中二维码
查看详细信息

03
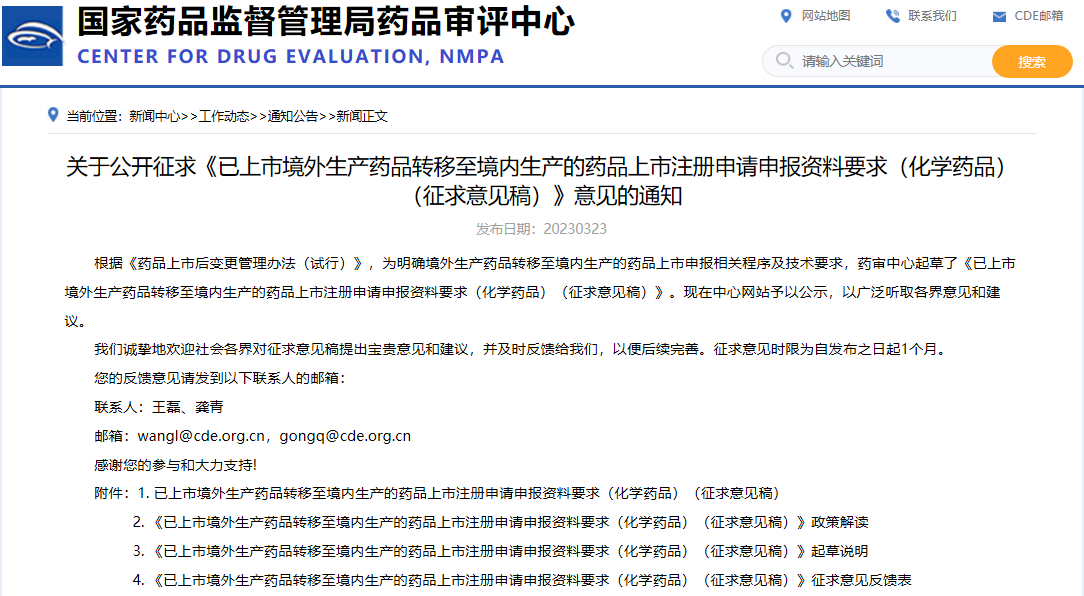
关于公开征求《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)(征求意见稿)》意见的通知
扫描识别图中二维码
查看详细信息

01
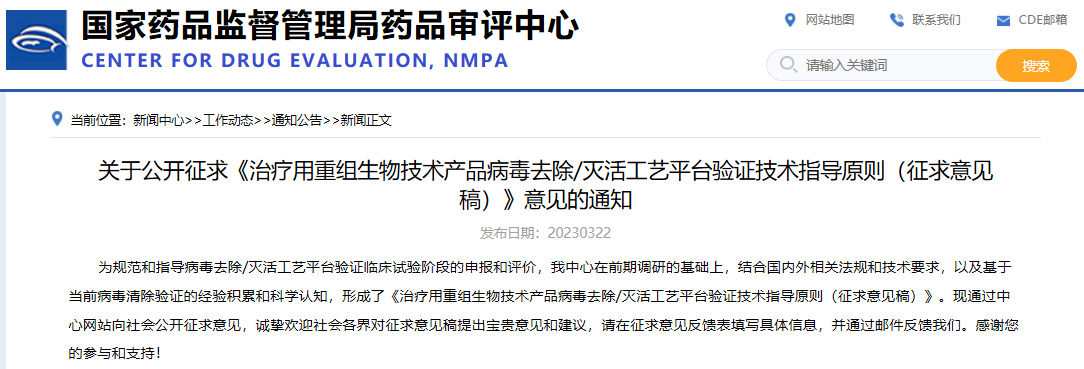
关于公开征求《治疗用重组生物技术产品病毒去除/灭活工艺平台验证技术指导原则(征求意见稿)》意见的通知
扫描识别图中二维码
查看详细信息

02
国家药监局药审中心关于发布《化药口服固体制剂连续制造技术指导原则(试行)》的通告(2023年第19号)

扫描识别图中二维码
查看详细信息

03
国家药监局药审中心关于发布《化学药品说明书及标签药学相关信息撰写指导原则(试行)》的通告(2023年第20号)

扫描识别图中二维码
查看详细信息

04
国家药监局药审中心关于发布《儿童抗肿瘤药物临床研发技术指导原则》的通告(2023年第22号)

扫描识别图中二维码
查看详细信息

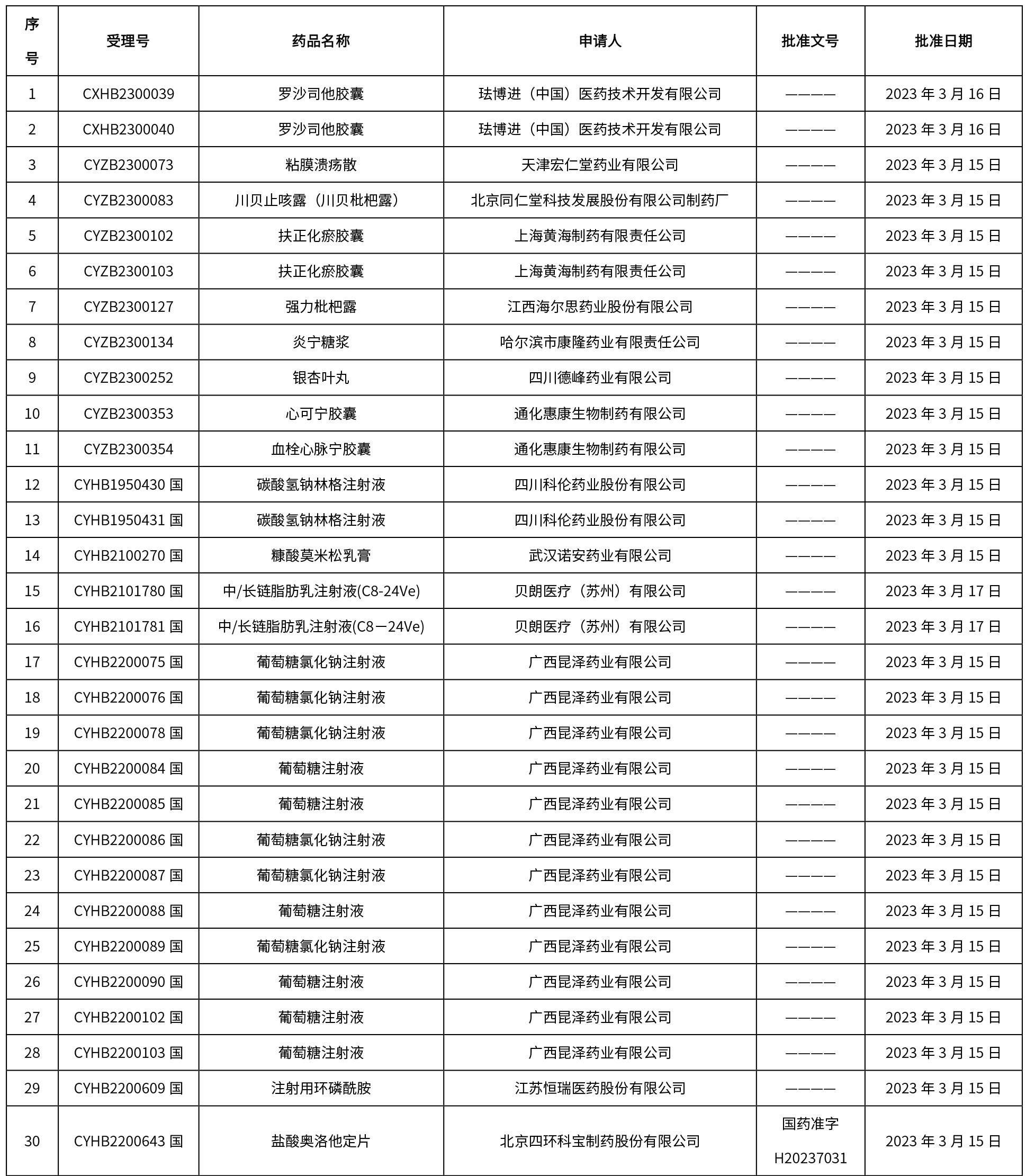
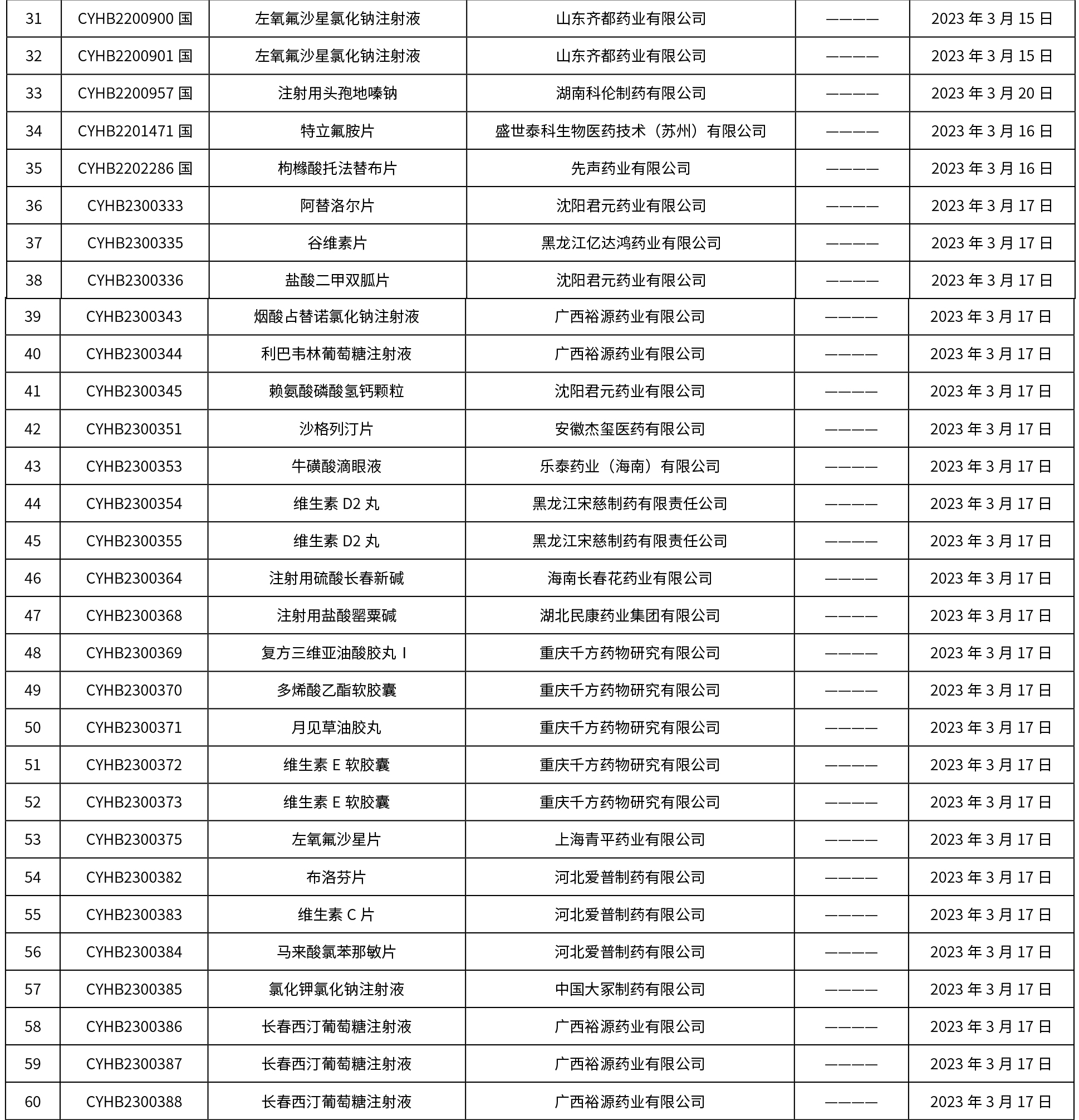
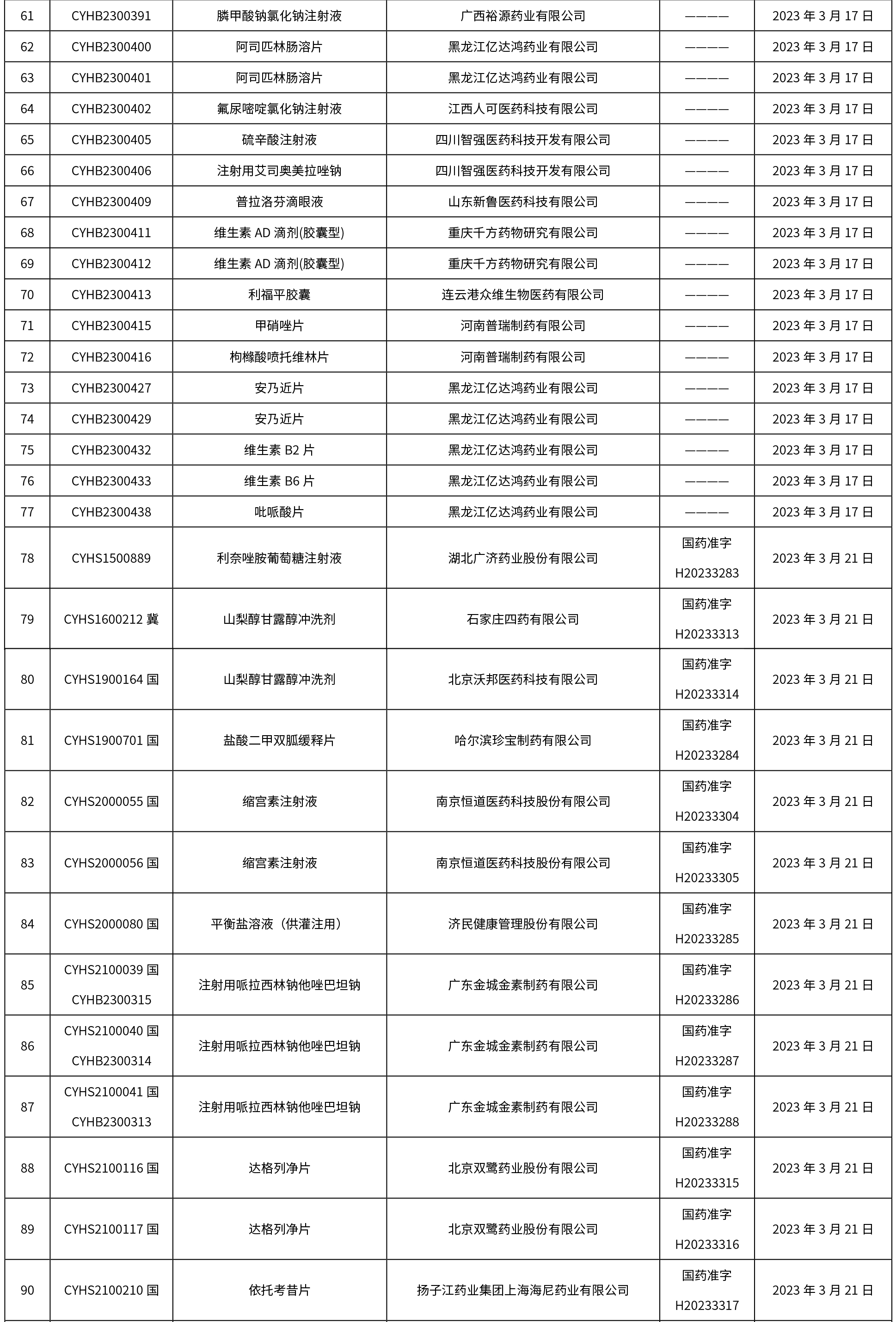
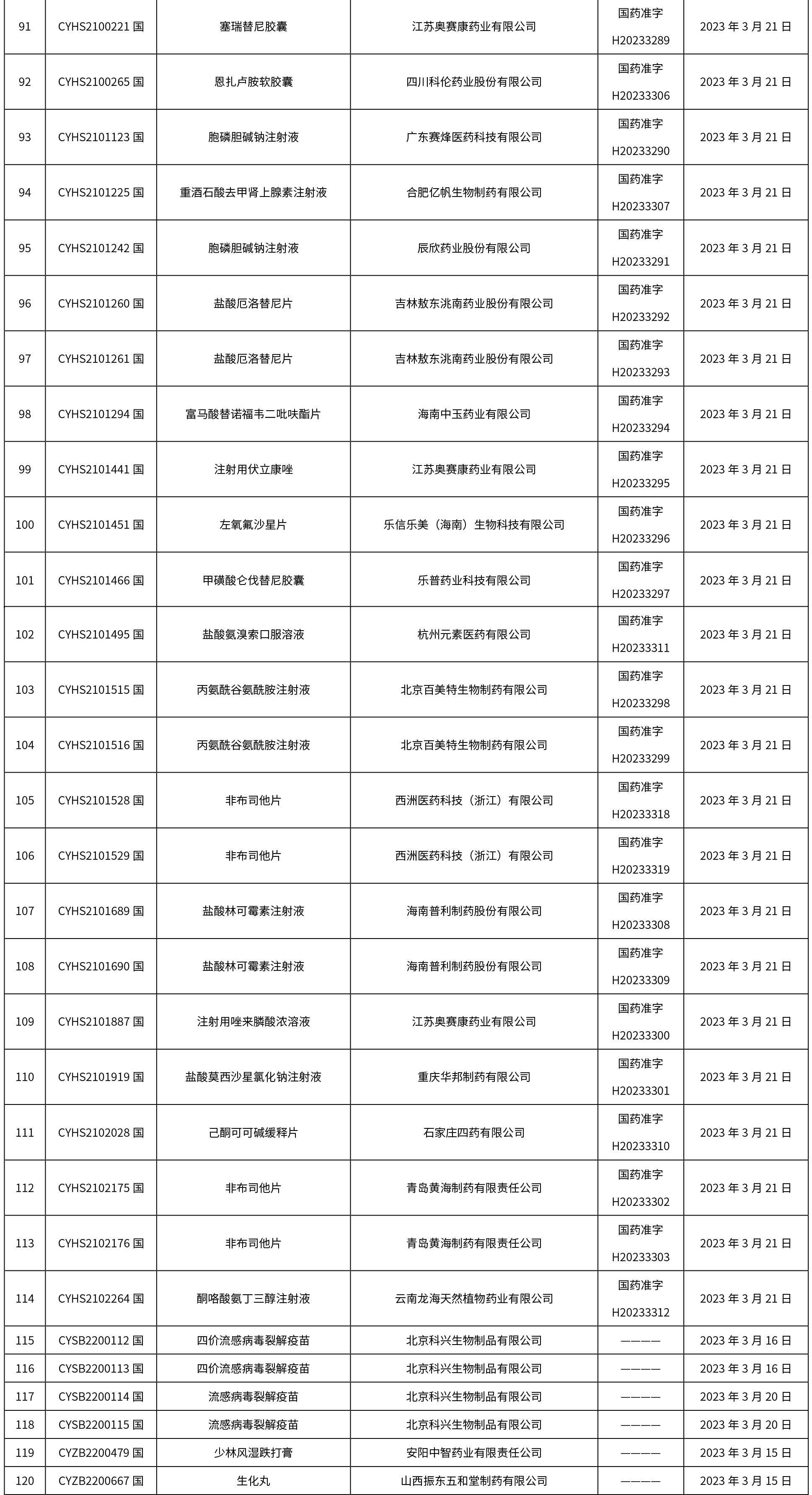
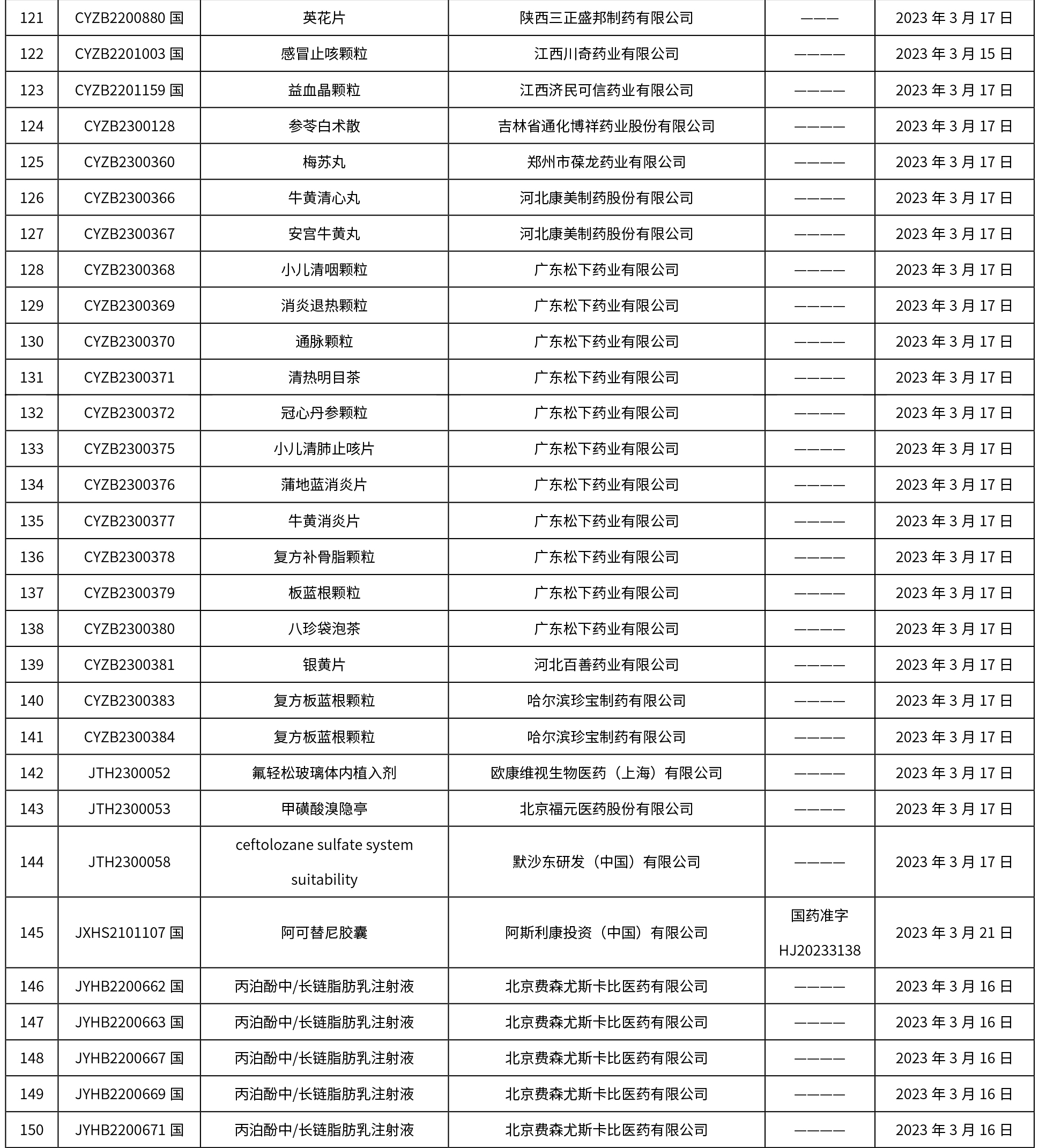
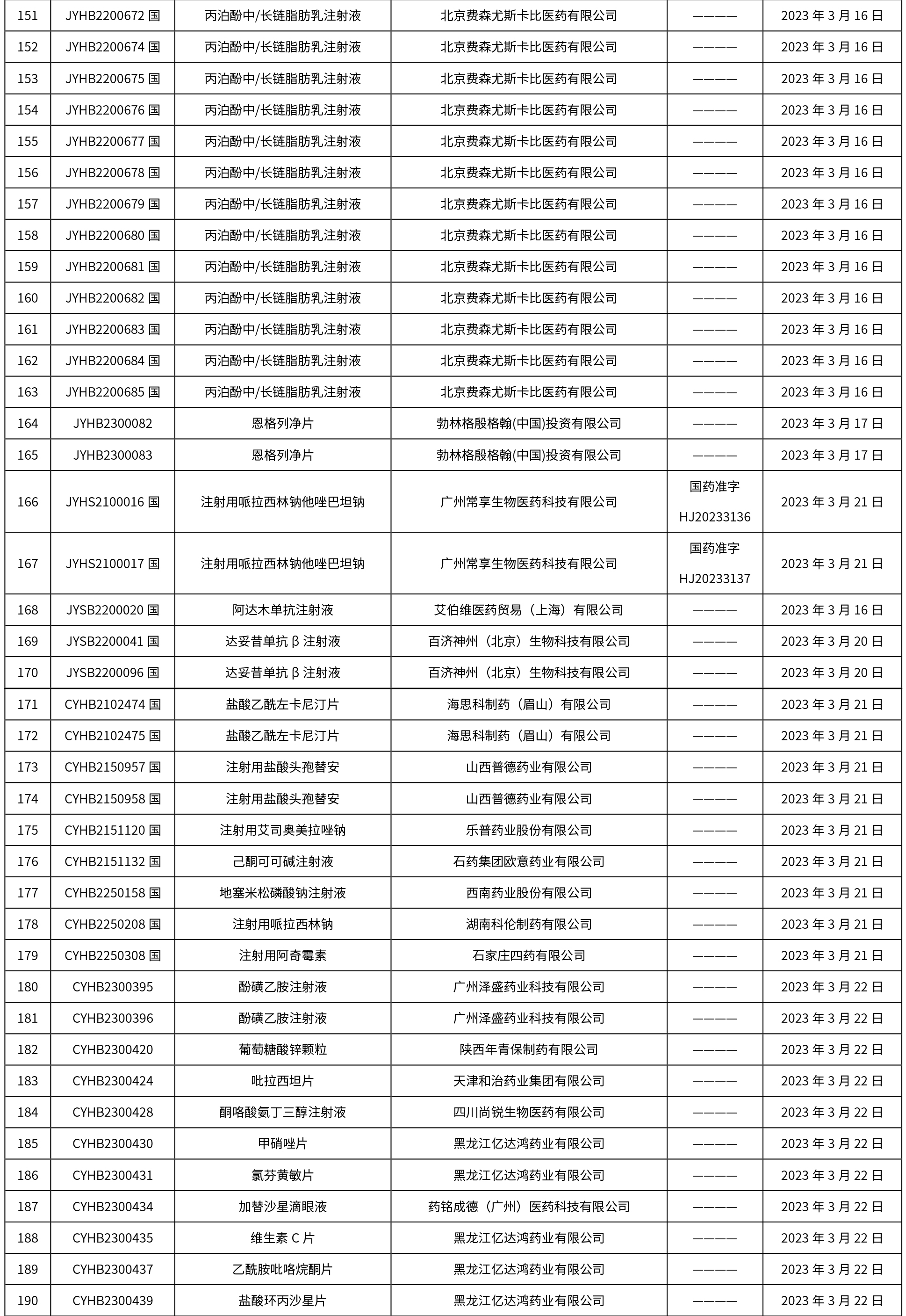
本周共发布了225个品规的药品批准证明文件待领取信息,一致性评价9个,注射剂86个。
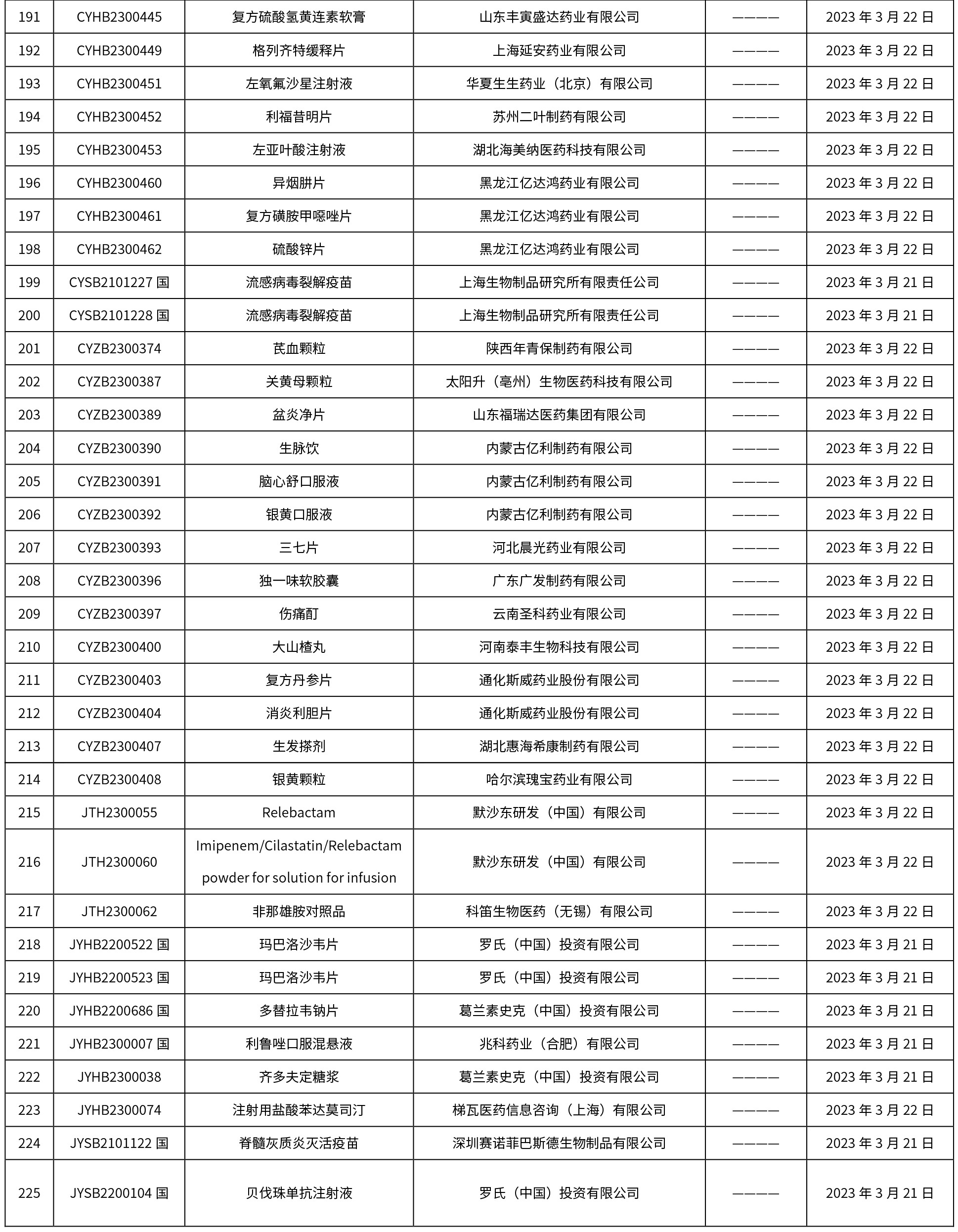
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450